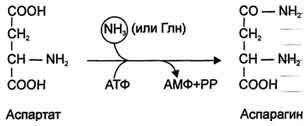
Ang pangunahing mekanismo para sa neutralisasyon ng ammonia sa katawan ay ang biosynthesis ng urea. Ang huli ay excreted sa ihi bilang pangunahing produkto ng dulo ng protina, ayon sa pagkakabanggit ng amino acid, metabolismo. Ang Urea ay umaabot ng hanggang sa 80-85% ng lahat ng nitrogen ng ihi. Ang pangunahing at marahil ang tanging site ng urea synthesis ay ang atay. Sa kauna-unahang pagkakataon, nakuha nina G. Krebs at K. Hanselyight noong 1932 ang mga equation para sa mga reaksyon ng urea synthesis, na ipinakita sa anyo ng isang ikot, na tinawag krebs urea ornithine cycle.
Dapat pansinin na sa biochemistry ito ang unang cyclic metabolic system, ang paglalarawan kung saan sa halos 5 taon ay natutukoy ng pagtuklas ni G. Krebs ng isa pang metabolic process - ang tricarboxylic acid cycle. Ang mga karagdagang pag-aaral ay higit na nakumpirma na ang siklo ng likas na katangian ng urea biosynthesis sa atay. Salamat sa pagsasaliksik ng G. Cohen, S. Ratner et al. ang mga intermediate na hakbang at mga sistema ng enzyme na nagpapagal sa pagbuo ng urea ay nilinaw.
Kaya, ang buong pag-ikot ng urea ay maaaring kinakatawan bilang mga sumusunod. Sa unang yugto, ang isang macroergic compound na carbamoyl phosphate ay synthesized - isang metabolikong aktibong anyo ng ammonia na ginamit bilang panimulang produkto para sa synthesis ng pyrimidine nucleotides (DNA at RNA, ayon sa pagkakabanggit) at arginine (protina at urea, ayon sa pagkakabanggit):
Ang Urea ay pangunahing produkto ng pagtatapos ng metabolismo ng nitrogen, sa komposisyon kung saan ang isang labis na nitrogen ay pinalabas mula sa katawan.
Ang ornithine cycle sa atay ay gumaganap ng dalawang pag-andar:
Ang pag-convert ng mga amino acid sa urea, na kung saan ay excreted at pinipigilan ang akumulasyon ng mga produktong nakakalason, pangunahin ang ammonia;
Sintesis ng arginine at pagdadagdag ng pondo nito sa katawan.
Isaalang-alang ang siklo ng urea:
![]()
Larawan 34 - Ornithine synthesis ng urea sa atay
Nagsisimula ito sa pagbuo ng carbamoyl phosphate sa mitochondria, kung saan mayroong maraming ATP.
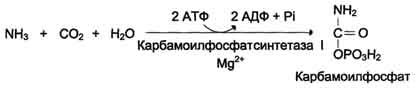
1 Ang pagbuo ng carbamoyl pospeyt. Ang mga ion ng ammonia na nagreresulta mula sa oxidative deamination ng glutamic acid ay nakikipag-ugnay sa bicarbonate anion at ATP kasama ang pakikilahok ng carbamoylphosphate synthetase, na bumubuo ng carbamoylphosphate na naglalaman ng isang macroergic bond:
NН 4 + + ННО 3 - + 2АТФ → Н 2 N - С + 2АДФ + Н 2 РО 4 - + Н +
Carbamoyl pospeyt
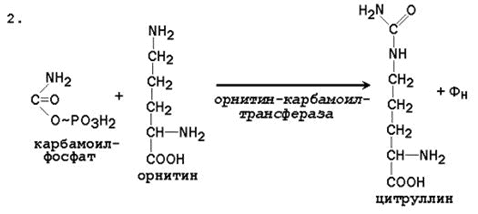
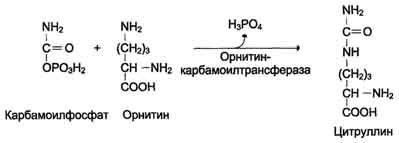
2. Pagkuha ng Citrulline. Sa mitochondrial matrix, ang carbamoyl phosphate condenses na may amino acid ornithine, na, bilang isang homologue ng lysine, ay hindi isang bahagi ng mga protina.
Ang reaksyon ay catalyzed ng ornithinecarbamoyltransferase:
Н СОО - О Н СОО -
С + Н 2 N - С → СО + Н 2 РО 4 -
+ / \ + \ + / \ ||
Н 3 N (СН 2) 3 НН 3 О ~ F H 3 N (CH 2) 3 NH - C - NH 2
Ornithine Carbamoyl Phosphate Citrulline
Ang nagresultang citrulline ay pumasa sa cytosol ng mga selula ng atay, kung saan nangyayari ang natitirang mga reaksyon ng siklo ng urea.
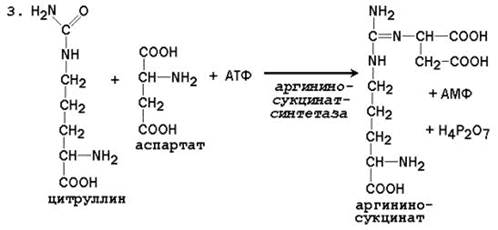
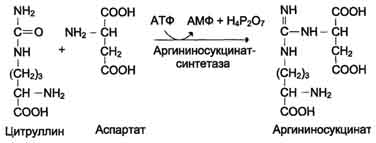
3. Produksyon ng Argininosuccinate. Ang kapalit ng carbonyl group ng citrulline kasama ang amino group ng aspartate na may pagbuo ng guanidine group of argininosuccinate ay nangyayari kasama ang pakikilahok ng ATP at napalakas ng argininosuccinate synthetase:
N SOO - N SOO -
C O + C + ATP →
Н 3 N (СН 2) 3 НН - С - НН 2 Н 3 N СН 2 СОО -
Aspartate ng Citrulline
С Н 2 N СН 2 СОО - + Н 2 Р 2 О 7 2- + AMP
Н 3 N (СН 2) 3 НН - С - НН - СНСОО -
Arginine succinate
Ang reaksyon ay energonic; 4 na mga molekula ng ATP ay natupok sa una at pangatlong reaksyon ng pag-ikot.
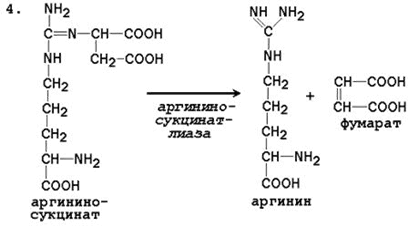
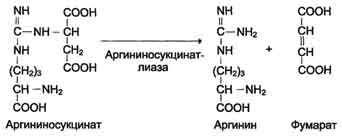
4. Pagkabulok ng Arginine Succinate. Sa ilalim ng pagkilos ng argininosuccinate lyase, ang argininosuccinate exergonically break down sa pagbuo ng arginine at fumarate:
N SOO - N SOO - SOO - N
С Н 2 N СН 2 СОО - → С Н 2 N + С \u003d С
+ / \ || | + / \ || / \
Н 3 N (СН 2) 3 НН - С - НН - СНСОО - Н 3 N (СН 2) 3 НН - С - NH 2 Н СОО -
Arginine Succinate Arginine Fumarate
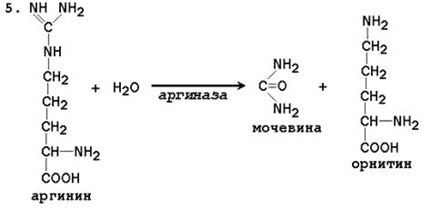
5. Ang pagbuo ng Urea at pagbabagong-buhay ng ornithine. Ang hydrolysis ng arginine, na-catalyzed ng arginase, ay humahantong sa pagbuo ng urea at ang pagbabagong-buhay ng ornithine. Ang reaksyon ay exergonic.
Н СОО - Н СОО - NН 2
С Н 2 N → С + О \u003d С
+ / \ || + / \ + \
H 3 N (CH 2) 3 NH - C - NH 2 H 3 N (CH 2) 3 NH 3 NH 2
Arginine Ornithine Urea
Ang nabagong ornithine ay maaaring makapasok muli sa mitochondria at makilahok sa isang bagong pag-turn over ng cycle ng urea. Ang paglilipat ng dugo urea na bumubuo mula sa atay hanggang sa mga bato, kung saan nakuha ito mula sa dugo at tinanggal mula sa katawan na may ihi.
Sa ornithine cycle, 4 na macroergic bond ng tatlong ATP molekula ay natupok para sa bawat rebolusyon ng ikot.
Gayunpaman, ang proseso ng pagbuo ng urea ay nagbibigay ng sarili ng enerhiya:
Sa panahon ng pagbabagong-buhay ng aspartate mula sa fumarate, ang NADH ay nabuo sa yugto ng dehydrogenation ng malate, na maaaring magbigay ng synthesis ng 3 macroergic bond.
Sa panahon ng oxidative deamination ng glutamate, ang NADH ay nabuo din sa iba't ibang mga organo, na maaaring magbigay ng synthesis ng 3 macroergic bond.
Mula sa mga reaksyon sa itaas makikita na ang nakakalason na ammonia ay nagiging hindi nakakapinsalang urea. Sa kasong ito, ang isa sa mga nitrogen ng urea ay nabuo mula sa ammonia, ang iba pa mula sa aspartate.
24.4.1. Urea biosynthesis- ang pangunahing paraan ng pag-neutralize ng ammonia. Ang Urea ay synthesized sa ornithine cycle sa mga selula ng atay. Ang pagkakasunud-sunod na reaksyon na ito ay natuklasan nina H. Krebs at K. Hanseleit noong 1932. Ayon sa mga modernong konsepto, ang siklo ng urea ay may kasamang pagkakasunud-sunod ng limang mga reaksyon.
Dalawang paunang reaksyon biosynthesis reaksyon ang nangyayari sa mitochondria ng mga selula ng atay.
Ang mga kasunod na reaksyon ay nagpapatuloy sa cytoplasm ng mga selula ng atay.
Ang pangkalahatang pamamaraan ng ornithine cycle ay ipinapakita sa Figure 24.2:
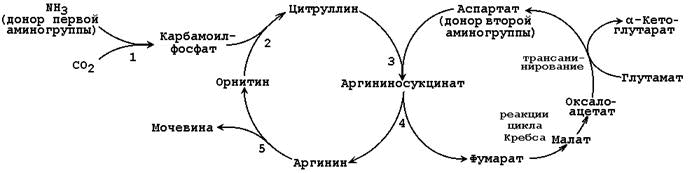
Larawan 24.2.Scheme ng ornithine cycle at ang kaugnayan nito sa mga pagbabagong-anyo ng fumaric at aspartic acid.
Ang mga numero ay nagpapahiwatig ng mga enzymes na nagpapagal sa mga reaksyon ng ornithine cycle: 1 - carbamoylphosphate synthetase; 2 - ornithine carbamoyltransferase; 3 - argininosuccinate synthetase; 4 - argininosuccinate; 5 - arginase.
24.4.2. Malapit na ang siklo ng Ornithine relasyon sa tricarboxylic acid cycle:
- mga reaksyon ng pag-trigger ng siklo ng urea, pati na rin ang mga reaksyon ng CTK, magpatuloy sa mitochondrial matrix;
- ang supply ng CO2 at ATP, na kinakailangan para sa pagbuo ng urea, ay sinisiguro ng pagpapatakbo ng CTK;
- sa siklo ng urea, nabuo ang fumarate, na kung saan ay isa sa mga substrate ng CTK. Fumarate hydrates upang malate, na naman ay na-oxidized sa oxaloacetate. Ang Oxaloacetate ay maaaring sumailalim sa transamination upang magbagsak; ang amino acid na ito ay kasangkot sa pagbuo ng arginosuccinate.
24.4.3. Regulasyon ng aktibidad ng enzyme ang ikot ay isinasagawa pangunahin sa antas ng carbamoylphosphate synthetase, na hindi aktibo sa kawalan ng allosteric activator na ito - N-acetyl-glutamate. Ang konsentrasyon ng huli ay nakasalalay sa konsentrasyon ng mga precursors nito (acetyl-CoA at glutamate), pati na rin ang arginine, na isang allosteric activator ng N-acetylglutamate synthase:
Acetyl-CoA + GlutamateN-acetylglutamate + CoA-SH
Ang konsentrasyon ng mga enzyme sa siklo ng ornithine ay nakasalalay sa nilalaman ng protina sa diyeta. Kapag lumipat sa diyeta na mayaman sa protina, ang synthesis ng ornithine cycle enzymes ay nagdaragdag sa atay. Sa pagbabalik sa isang balanseng diyeta, bumababa ang konsentrasyon ng mga enzyme. Sa ilalim ng mga kondisyon ng gutom, kapag ang pagbagsak ng mga protina ng tisyu at ang paggamit ng mga amino acid habang ang mga substrate ng enerhiya ay pinahusay, ang pagtaas ng produksyon ng ammonia, ang konsentrasyon ng ornithine cycle enzymes ay nagdaragdag.
24.4.4. Mga karamdaman sa ikot ng ornithine. Ang mga metabolikong karamdaman ay kilala dahil sa bahagyang pagharang ng bawat isa sa 5 mga enzim na nagpapagana sa reaksyon ng urea synthesis sa atay, pati na rin ang N-acetylglutamate synthase. Ang mga genetic defect na ito ay malinaw naman na bahagyang. Ang kumpletong pag-block ng alinman sa mga yugto ng siklo ng urea sa atay ay tila hindi kaayon sa buhay, dahil walang ibang epektibong paraan upang matanggal ang ammonia.
Ang isang karaniwang pag-sign ng lahat ng mga karamdaman ng urea synthesis ay isang pagtaas ng nilalaman ng NH4 + sa dugo ( hyperammonemia) Ang pinaka-malubhang klinikal na pagpapakita ay sinusunod na may isang depekto sa carbamoylphosphate synthetase enzyme. Ang mga klinikal na sintomas na karaniwang sa lahat ng mga karamdaman sa siklo ng yurya ay kasama ang pagsusuka, may kapansanan na koordinasyon sa motor, pagkamayamutin, pag-aantok, at pag-undang sa pag-iisip. Kung ang sakit ay hindi nasuri, pagkatapos ay mabilis na nagsisimula ang kamatayan. Sa mas matatandang mga bata, ang mga paghahayag ng sakit ay nadagdagan ang excitability, isang pagtaas sa laki ng atay at isang pag-iwas sa pagkain na may mataas na nilalaman ng protina.
Ang diagnosis ng laboratoryo ng mga sakit ay nagsasama ng pagpapasiya ng ammonia at metabolites ng ornithine cycle sa dugo, ihi at cerebrospinal fluid; sa mga mahihirap na kaso, gumawa ng isang biopsy sa atay.
Ang makabuluhang pagpapabuti ay sinusunod sa isang paghihigpit ng protina sa diyeta, habang maraming mga sakit sa utak ang maiiwasan. Ang isang diyeta na may mababang protina ay humantong sa pagbaba ng nilalaman ng ammonia sa dugo at sa isang pagpapabuti sa klinikal na larawan sa banayad na mga form ng mga namamana na karamdaman. Ang pagkain ay dapat dalhin nang madalas, sa maliit na bahagi, upang maiwasan ang isang matalim na pagtaas sa antas ng ammonia sa dugo.
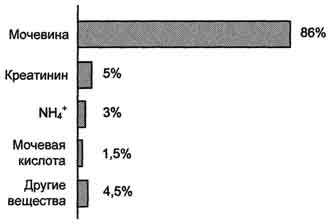
24.4.5. Klinikal at diagnostic na halaga ng pagpapasiya ng urea sa dugo at ihi. Sa dugo ng isang malusog na tao, ang nilalaman ng urea ay 3.33 - 8.32 mmol / L. Para sa isang araw na may ihi, 20 - 35 g ng urea ay pinalabas.
Ang mga pagbabago sa urea ng dugo sa mga sakit ay nakasalalay sa ratio ng mga proseso ng pagbuo nito sa atay at pag-aalis ng mga bato. Ang isang pagtaas ng urea ng dugo (hyperazotemia) ay nabanggit na may kabiguan sa bato, isang pagbaba - na may pagkabigo sa atay, na may diyeta na mababa sa protina.
Ang tumaas na pag-ihi ng urya ng ihi ay sinusunod kapag kumakain ng mga pagkain na may mataas na protina, sa mga sakit na sinamahan ng nadagdagan na catabolismong protina sa mga tisyu, habang kumukuha ng ilang mga gamot (halimbawa, salicylates). Ang isang pagbawas sa pag-ihi ng urya ng urinary ay katangian ng mga sakit at nakakalason na sugat ng atay, sakit sa bato, na sinamahan ng isang paglabag sa kanilang pagsasala.
Ang Ammonia ay isa sa mga pangwakas na produkto ng pagpapalitan ng mga sangkap na naglalaman ng nitrogen. Ito ay isang bahagi ng natitirang bahagi ng nitrogen ng suwero ng dugo (kasama ang urea, uric acid, creatinine, indican). Sa dugo, mababa ang konsentrasyon ng ammonia - 25-40 micromol / l. Sa mas mataas na konsentrasyon, mayroon itong nakakalason na epekto sa katawan.
Ang amonia ay nakakalason, lalo na para sa gitnang sistema ng nerbiyos. Ang pagkakalason ng ammonia ay nauugnay sa kakayahang maputol ang paggana ng CLK, sapagkat Tinatanggal ng NH 3 mula sa CLK-ketoglutarate:
- KG + NH 3 + NADH. H + Glu + OVER + + H 2 O.
Bilang isang resulta, muling pagbabalik sa aminKet - keto - glutarate, may pagbawas sa aktibidad ng CLK sa mga cell ng gitnang sistema ng nerbiyos, na, sa turn, pinipigilan ang aktibidad ng aerobic oksihenasyon ng glucose. Bilang isang resulta, ang produksyon ng enerhiya ay nabalisa at isang hypoenergetic na estado ang bumubuo, sapagkat glucose ay ang pangunahing mapagkukunan ng enerhiya para sa utak.
NH 3 nabuo sa mga sumusunod na proseso :
1) oxidative deamination ng mga amino acid - ito ang pangunahing ruta ng paggawa ng NH 3;
deamination ng biogenic amines;
deamination ng mga purine base (adenine, guanine);
catabolism ng pyrimidine nucleotides.
Sa utak, ang pangunahing mapagkukunan ng pagbuo ng NH 3 ay ang pagpapamatay ng AMP sa inosine monophosphate (IMP):
AMP + H 2 Oh IMP +NH 3 .
Ang enzyme na nagpapagana sa reaksyon na ito ay adenosine deaminase.
Ang amonia ay dinadala ng dugo sa atay at bato para sa neutralisasyon sa komposisyon ng mga amino acid, na kung saan ang pangunahing mga ito ay glutamine, asparagine, alanine.
Ang neutralisasyon ng NH 3 ay nangyayari halos kaagad pagkatapos ng pagbuo nito, sapagkat sa mga tisyu, agad itong isinama sa komposisyon ng mga amino acid, higit sa lahat glutamine. Gayunpaman, para sa karagdagang detoxification at pag-aalis ng ammonia, mayroong mga biochemical na proseso sa atay at bato, na kung saan ang pangunahing paraan ng pag-neutralize sa NH 3.
Ilalaan ang sumusunod mekanismo ng decontamination NH 3 :
1 ) reductive amination ng -ketoglutarate;
2 ) ang pagbuo ng mga amides ng amino acid - asparagine at glutamine;
3 ) ang pagbuo ng mga ammonium salts sa bato;
4 ) pagbubuo ng urea.
Sa mga tisyu, ang ammonia ay napapailalim sa agarang pag-neutralize. Nakamit ito sa pamamagitan ng isang kumbinasyon ng mga proseso ( 1 ) at ( 2 ).
Pagbabawas ng pagsasama -Ketoglutarate:
NH 3 + -KG + NADN . N + Glu + NAD + N 2 O.
Ang enzyme - glutamate dehydrogenase
Ang prosesong ito ay nangangailangan ng makabuluhang konsentrasyon ng - KG. Upang maiwasan ang labis na paggastos ng - KG at ang operasyon ng CLK na hindi mapang-abala, - Ang KG ay na-replenished dahil sa pag-convert ng PVKOA - KG.
2 )Pagbubuo ng amideAy isang mahalagang mekanismo ng pandiwang pantulong para sa pag-neutralize ng NH 3 sa mga tisyu sa pamamagitan ng pag-iikot nito sa Glu o Asp.
Asp + ATP +NH 3 ASN + AMP + FF nn
Ang enzyme - asparagine synthase
Glu + ATP +NH 3 Gln + AMP + FF nn
Enzyme - glutamine synthase
Ang prosesong ito ay pinaka-aktibo sa gitnang sistema ng nerbiyos, kalamnan, bato, at atay (upang mapanatili ang panloob na konsentrasyon ng NH 3). Kadalasan glnay isang form ng transportasyon ng nontoxic NH 3 mula sa utak, kalamnan, at iba pang mga tisyu. Ang glutamine ay madaling tumagos sa lamad, sapagkat sa physiological pH, wala itong bayad. Sa panahon ng ehersisyo, ang alanine ay aktibong nakadala sa NH 3 mula sa kalamnan hanggang sa atay. Bilang karagdagan, ang isang malaking halaga ng alanine ay naglalaman ng dugo na dumadaloy mula sa mga bituka. Ang alanine na ito ay ipinadala din sa atay para sa gluconeogenesis.
3 ) Ang gln at ASN na may daloy ng dugo ay pumapasok sa mga bato, kung saan sumailalim sila sa hydrolysis gamit ang mga espesyal na enzim - glutaminase at asparaginase, na matatagpuan din sa atay:
Asn + H 2 OAsp + NH 3.
Gln + H 2 OGlu + NH 3.
Napalaya sa mga tubule ng mga bato NH 3 ay neutralisado ang pagbuo ng mga ammonium salts,na pinalabas sa ihi:
NH 3 + H + + Cl - NH 4 Cl.
4 )Synthesis ng Urea- Ito ang pangunahing paraan upang ma-neutralize ang ammonia. Urea account para sa 80% ng excreted nitrogen.
Ang proseso ng pagbuo ng urea ay nangyayari sa atay at ito ay isang proseso ng siklo na tinatawag na " ornithine cycle "(Krebs - Hanselight cycle).
Ang dalawang amino acid na hindi bahagi ng mga protina, ornithine at citrulline, at dalawang proteinogen amino acid, arginine at asparagine, ay nakikibahagi sa siklo.
Kasama sa proseso ang limang reaksyon: ang unang dalawang magpatuloy sa mitochondria, ang natitira sa cytosol ng mga hepatocytes. Ang ilang mga enzyme na bumubuo ng urea ay matatagpuan sa utak, pulang selula ng dugo, at kalamnan ng puso, gayunpaman, ang buong hanay ng mga enzyme ay matatagpuan lamang sa atay.
І reaksyonAy ang synthesis ng carbamoyl pospeyt:
СО 2 + NH 3 + 2ATPNH 2 –CO - Ф + 2ADP + Ф n.
Enzyme - carbamoyl pospeyt synthaseІ (mitochondrial). Mayroon ding carbamoylphosphate synthase II (sa cytosol), na kung saan ay kasangkot sa synthesis ng pyrimidine nucleotides.
Ang Carbamoylphosphate synthase I ay isang regulasyon na enzyme kung saan activator ay N-Acetylglutamate.
ІІ reaksyon- ang pagsasama ng carbamoyl pospeyt sa proseso ng siklo. Sa reaksyong ito, nagpapalubha ito ng ornithine), na nagreresulta sa pagbuo ng citrulline (ang reaksyon ay nangyayari din sa mitochondria).
III reaksyon- ang pagbuo ng arginine succinate. Ito ang pangalawang reaksyon na gumagamit ng enerhiya ng ATP.
IV reaksyon- cleavage ng arginine succinate sa pagbuo ng arginine at fumarate. Ang huli ay maaaring makapasok sa Central Control Commission, pagpapahusay ng gawain nito. T.O. Ito ay isang anaplerotic (muling pagdadagdag) reaksyon para sa CLK.
V reaksyon -pagbabagong-buhay ng ornithine kasama ang pagbuo ng urea.
Scheme ng Urea Synthesis
CO 2 + NH 3 + 2ATPcarbamoylphosphate + 2ADP + F n
NH 2 –CO - NH 2
 (urea)Ornithine
(urea)Ornithine
5 2
ArginineCitrulline
4 3 ATP
Fumarate AMF
Arginine succinateFf n
Mga Enzim:
1 - carbamoyl pospeyt synthase;
2 - ornithinecarbamoyltransferase;
3 - argininosuccinate synthase;
4 - argininosuccinate lyase;
5 - arginase(Ang mga malakas na inhibitor ng enzyme ay ornithine at lysine, nakikipagkumpitensya sa arginine, activator - Ca 2+ at Mn 2+).
Ang Ornithine, na naibalik sa panahon ng pag-ikot, ay maaaring mag-trigger ng isang bagong ikot ng urea. Sa papel nito, ang ornithine ay katulad ng oxaloacetate sa CLK. Upang makumpleto ang isang siklo, kinakailangan ang 3 ATP, na ginagamit sa 1st at 3rd reaksyon.
Ang ornithine cycle ay malapit na magkakaugnay sa CLK.
Sa eskematiko, ang relasyon ay maaaring maitala sa mga sumusunod:
Ornith-CO 2
bagong TsLK
ang siklo
Fumarate ATP
Aspartate
Ito ang "dalawang gulong bisikleta" ni Krebs - hindi isang solong gulong ang maaaring "paikutin" nang walang wastong paggana ng pangalawa.
Ang paglabas ng synthesized urea ay ibinibigay ng mga bato. Ang 20-35 g ng urea ay pinakawalan bawat araw. Kapag binabago ang dami ng protina sa pagkain upang mapanatili ang balanse ng nitrogen, ang rate ng pagbubuo ng urea sa katawan ay nagbabago:
protina na may pagkain synthesis ng mga enzymes ng cycle urea synthesis,
kung protina catabolism urea synthesis at ang dami
output nitrogen.
Ang pagtaas ng katabolismo ng protina at, dahil dito, ang pagtaas ng pag-iiba ng urea ay sinusunod sa panahon ng pag-aayuno at diabetes mellitus.
Sa mga sakit ng atay, na sinamahan ng kapansanan na synthesis ng urea, ang konsentrasyon ng ammonia sa dugo (hyperammonemia) ay nagdaragdag at, bilang isang resulta, ang hepatic coma ay bubuo.
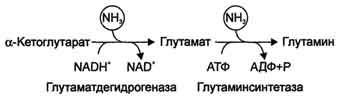
Ang amonia ay nabuo bilang isang resulta ng deamination ng mga amino acid, amides, amines, pati na rin ang mga nucleotide. Ang pangunahing mapagkukunan ng ammonia ay ang oksihenasyon ng glutamate glutamate dehydrogenase, na nangyayari sa halos lahat ng mga tisyu ng katawan.
Yamang ang ammonia ay isang sobrang nakakalason na sangkap, lalo na para sa sistema ng nerbiyos, sa proseso ng ebolusyon, ang mga mekanismo ng neutralisasyon nito ay nabuo sa katawan ng tao. Ang antas ng ammonia sa dugo ay karaniwang hindi lalampas sa 50 μmol / L. Ang toxicity ng amonia ay dahil sa maraming mga kadahilanan. Sa mga tisyu at likido sa katawan, ang ammonia ay higit sa lahat sa anyo ng isang cation ng ammonium (NH 4 +), na tumagos nang mahina sa pamamagitan ng mga lamad. Ngunit tungkol sa 1% ng libreng ammonia ay nasa balanse na may NH4 +, madali itong dumaan sa mga lamad. Sa mitochondria, ang ammonia ay nakikipag-ugnay sa alpha-ketoglutarate sa reverse glutamate dehydrogenase reaksyon upang makagawa ng glutamate. Ang isang mataas na nilalaman ng ammonia ay pinasisigla ang pag-agos ng alpha-ketoglutarate mula sa citric acid cycle at, dahil dito, isang pagbawas sa mitochondrial oksihenasyon at syntyor ng ATP, at ang pinaka-sensitibong mga selula ng utak ay binibigyan ng enerhiya halos ganap na dahil sa aerobic decomposition ng glucose.
Ang mga pangunahing produkto ng pagtatapos ng metabolismo ng ammonia sa mga hayop at mga tao ay urea, ang pagbuo ng kung saan nangyayari sa atay. Ang amonia ay inililipat mula sa peripheral na mga tisyu sa atay at bato sa anyo ng glutamine. Ang amino acid na ito ay nabuo mula sa glutamic acid sa pamamagitan ng pagdaragdag ng ammonia sa ilalim ng pagkilos ng glutamine synthetase.
Ang Glutamine ay isang neutral, hindi nakakalason na tambalan na, hindi tulad ng glutamate, ay madaling dumaan sa mga lamad ng cell. Sa utak, ang pagkilos ng glutamine synthetase ay pinagsama sa pagkilos ng glutamate dehydrogenase, na gumaganap lalo na sa direksyon ng glutamate synthesis na may alpha-ketoglutarate. Mula sa utak, ang glutamine ay malayang nagkakalat sa dugo o cerebrospinal fluid, habang tinatanggal ang dalawang molekula ng nakakalason na ammonia.
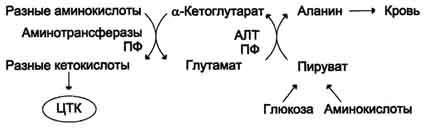
Ang glutamine synthetase ay aktibo rin sa atay. Dito, pinapanatili nito ang intracellular na konsentrasyon ng ammonia sa isang antas na hindi maabot ang mga limitasyon ng toxicity. Sa atay at bato, ang glutamine ay hydrolyzed ng glutaminase upang glutamate at libreng ammonia. Ang isang neutral na amino acid, alanine, ay kasangkot sa transportasyon ng ammonia mula sa mga kalamnan hanggang sa atay. Sa panahon ng matinding kalamnan na gawa, ang bahagi ng mga amino acid ay na-convert sa glucose sa pamamagitan ng gluconeogenesis. Sa ilalim ng mga kondisyong ito, ang isang makabuluhang halaga ng ammonia ay nabuo sa mga kalamnan. Ang amonia ay nakikipag-ugnay sa alpha-ketoglutarate, nabuo ang glutamate. Ang huli ay nakikipag-ugnay sa pyruvate, ang nilalaman ng kung saan ay nagdaragdag dahil sa pagtaas ng glycolysis sa panahon ng operasyon. Ang isang reaksyon ng transamination ay nangyayari sa pagitan ng pyruvate at glutamate.
Ang Alanine ay inilipat na may dugo sa atay, kung saan, sa ilalim ng pagkilos ng alanine aminotransferase, inililipat nito ang pangkat ng amino na alpha-ketoglutarate, at pagkatapos ay ang ammonia ay pinalaya mula sa glutamate sa reaksyon ng glutamate dehydrogenase. Sa pyruvate sa atay, ang glucose ay resynthesized, na muling ginagamit sa mga kalamnan.
Ang proseso ng cyclic urea synthesis ay natuklasan nina G. Krebs at K. Henselight noong 1932. Ang dalawang amino acid na hindi bahagi ng mga protina (ornithine at citrulline), at dalawang amino acid na nilalaman ng mga protina (arginine at aspartate) ay lumahok sa siklo. Natuklasan ng Krebs at Henselight na ang rate ng synthesia ng urea ay tumataas nang malaki kapag ang ornithine, arginine, o citrulline ay idinagdag sa daluyan. Batay sa mga katotohanang ito, iminungkahi ni Krebs ang isang scheme ng synthesis ng urea. Ang siklo ay binubuo ng 5 reaksyon, ang bawat isa ay na-catalyzed ng isang hiwalay na enzyme.
Ang siklo ng urea at ang citric acid cycle ay malapit na nauugnay. Kaya, ang supply ng CO2 at ATP, kinakailangan para sa pagbuo ng urea, ay sinisiguro ng gawain ng siklo ng sitriko acid. Ang fumaric acid, na nabuo sa pamamagitan ng cleavage ng argininosuccinate, kasama ang pakikilahok ng mga enzymes ng citric acid cycle ay na-convert mula sa malate sa oxaloacetate, at ang huli ay nagbibigay ng aspartate muli sa transamination reaksyon na may glutamate. Ang direktang mapagkukunan ng mga nitrogen atoms sa molekula ng urea ay ammonia at aspartate. Pareho sa mga ito ay maaaring makuha mula sa glutamo: ammonia - sa pamamagitan ng oxidative deamination, aspartate - transamination. At salamat sa transamination na may alpha-ketoglutarate, ang lahat ng mga amino acid ay nakapagbigay sa mga pangkat ng amino sa urea, ang pangwakas na produkto ng catabolism ng mga amino acid sa katawan ng tao.
V. PAGBABAGO NG AMMONIA
A. Mga SOURCES NG AMMONIA SA CELLS
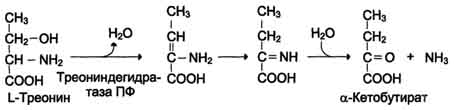
Ang catabolism ng mga amino acid sa mga tisyu ay nangyayari palaging sa rate na of100 g / araw. Sa kasong ito, bilang isang resulta ng deamination ng mga amino acid, inilabas ang isang malaking halaga ng ammonia.
Scheme A
Scheme B
Scheme B
Ang mga makabuluhang mas maliit na halaga nito ay nabuo sa panahon ng pag-deamine ng mga biogenous na amin at mga nucleotide. Ang mga pangunahing mapagkukunan ng ammonia sa mga cell ay iniharap sa talahanayan. 9-3.
Ang bahagi ng ammonia ay nabuo sa mga bituka.bilang isang resulta ng pagkilos ng bakterya sa mga protina ng pagkain ( pagkabulok ng mga protina sabituka) at pumapasok sa portal vein dugo. Ang konsentrasyon ng ammonia sa dugo ng portal vein ay makabuluhang mas mataas kaysa sa pangkalahatang daloy ng dugo. Ang isang malaking halaga ng ammonia ay pinananatili sa atay, na nagpapanatili ng isang mababang nilalaman nito sa dugo. Ang konsentrasyon ng ammonia sa dugo ay karaniwang bihirang lumampas sa 0.4-0.7 mg / l (o 25-40 micromol / l). Sa mga halagang pH physiological, ang ammonia sa dugo at cytosol ng mga cell ay pumapasok sa ion ng ammonium - NH4 +, ang halaga ng di-ionized NH 3 ay maliit (~ 1%).
Ang amonia ay isang nakakalason na tambalan. Kahit na ang isang bahagyang pagtaas sa konsentrasyon nito ay may masamang epekto sa katawan, at lalo na sa gitnang sistema ng nerbiyos. Kaya, ang isang pagtaas sa konsentrasyon ng ammonia sa utak sa 0.6 mmol ay nagiging sanhi ng mga seizure. Ang mga simtomas ng hyperammonemia ay may kasamang panginginig, slurred speech, pagduduwal, pagsusuka, pagkahilo, pag-agaw, at pagkawala ng kamalayan. Sa mga malubhang kaso, ang isang pagkawala ng malay sa isang malubhang kinalabasan.
Ang mekanismo ng nakakalason na epekto ng ammoniasa utak at katawan nang buo, malinaw naman, ay nauugnay sa pagkilos nito sa maraming mga functional system.
- Ang amonia ay madaling tumagos sa mga lamad sa mga cell at, sa mitochondria, inilipat ang reaksyon na na-catalyzed ng glutamate dehydrogenase tungo sa pagbuo ng glugamate:
α-Ketoglutarate + NADH + H + + NH 3 → Glutamate + NAD +.
Ang pagbawas sa konsentrasyon ng α-ketoglutarate ay sanhi:
- pang-aapiang pagpapalitan ng mga amino acid (trans-mining reaksyon) at, dahil dito, ang synthesis ng mga neurotransmitters (acetylcholine, dopamine, atbp.) mula sa kanila;
- hypoenergetic estado sabilang isang resulta ng pagbawas sa bilis ng CTK
Talahanayan 9-3. Ang pangunahing mapagkukunan ng ammonia
| Pinagmulan | Ang proseso | Mga Enzim | Proseso ang lokalisasyon |
| Mga amino acid | Indirect deamination (ang pangunahing ruta para sa deamination ng mga amino acid) | Aminotransferases, PF Glutamate dehydrogenase, NAD + | Lahat ng tela |
| Ang glutamate oxidative deamination | Glutamate dehydrogenase, NAD + | Lahat ng tela | |
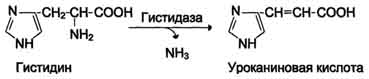
| Non-oxidizing deamination ng Gis, Ser, Tre | Ang Histidase-Serine, threonine dehydratase, PF | Pangunahin ang atay | |
| Ang Oxidative deamination ng mga amino acid (hindi gaanong kabuluhan na paraan ng pagpapapatay) | L-amino acid oxidase, FMN | Atay at bato | |
| Mga biogenic na amin | Oxidative deamination (landas ng hindi aktibo na biogenic amines) | Amino Oxidases, FAD | Lahat ng tela |
| AMF | Hydrolytic deamination | AMP deaminase | Masidhing nagtatrabaho kalamnan |
Ang kakulangan ng α-ketoglutarate ay humantong sa isang pagbawas sa konsentrasyon ng mga metabolite ng CTK, na nagiging sanhi ng isang pabilis ng synthesis ng oxaloacetate mula sa pyruvate, na sinamahan ng masinsinang pagkonsumo ng CO 2. Ang nadagdagan na pagbuo at pagkonsumo ng carbon dioxide sa panahon ng hyperammonemia lalo na ang katangian ng mga selula ng utak.
- Ang isang pagtaas sa konsentrasyon ng ammonia sa dugo ay nagbabago ng pH sa alkalina na bahagi (sanhi alkalosis) Ito naman, ay nagdaragdag ng kaakibat ng hemoglobin para sa oxygen, na humahantong sa tisyu ng hypoxia, ang akumulasyon ng CO 2 at isang hypoenergetic state, kung saan higit na naghihirap ang utak.
- Mataas na ammonia concentrations pasiglahin ang synthesis ng glutaminemula sa glutamate sa nerve tissue (na may pakikilahok ng glutamine synthetase):
Glutamate + NH 3 + ATP → Glutamine + ADP + H 3 P0 4.
- Ang akumulasyon ng glutamine sa mga selula ng neuroglia ay humantong sa isang pagtaas sa osmotic pressure sa kanila, ang pamamaga ng mga astrocytes at sa mataas na konsentrasyon ay maaaring maging sanhi ng edema ng utak. Pagbawas ng glutamonakakagambala sa metabolismo ng mga amino acid at neurotransmitters, lalo na synthesis ng y-aminobutyric acid(GABA), ang pangunahing tagapamagitan ng preno. Sa kakulangan ng GABA at iba pang mga tagapamagitan, ang pagpapadaloy ng isang salpok ng nerbiyos ay nabalisa, nangyayari ang mga kombulsyon.
- Ang NH 4 + ion ay praktikal na hindi tumagos sa mga lamad ng cytoplasmic at mitochondrial. Ang labis na ammonium ion sa dugo ay may kakayahang makagambala sa paglilipat ng transmembrane ng monovalent Na + at K + na mga kasyon, na nakikipagkumpitensya sa kanila para sa mga channel ng ion, na nakakaapekto rin sa pagpapadaloy ng mga impulses ng nerve.
B. Pagbubuklod (neutralisasyon) ng ammonia
Ang mataas na intensity ng mga proseso ng deamination ng mga amino acid sa mga tisyu at ang napakababang antas ng ammonia sa dugo ay nagpapahiwatig na ang ammonia ay aktibong nagbubuklod sa mga cell na may pagbuo ng mga hindi nakakalason na mga compound na excreted mula sa katawan na may ihi. Ang mga reaksyong ito ay maaaring isaalang-alang na reaksyon ng neutralization. Maraming mga uri ng naturang mga reaksyon ay natagpuan sa iba't ibang mga tisyu at organo.
Ang pangunahing reaksyon ng nagbubuklod na ammonia na nangyayari sa lahat ng mga tisyu ng katawan
glutamine synthesis sa pamamagitan ng glutamine synthetase:
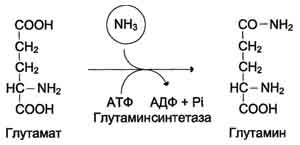
Ang glutamine synthetase ay naisalokal sa mitochondria ng mga cell, para gumana ang enzyme, isang cofactor, Mg 2+ ion, ay kinakailangan. Ang glutamine synthetase ay isa sa mga pangunahing regulasyon ng enzymes para sa metabolismo ng amino acid at allosterically inhibited ng AMP, glucose-6-phosphate, pati na rin Gly, Ala at His.
Ang Glutamine ay madaling dalhin sa pamamagitan ng mga lamad ng cell sa pamamagitan ng pagpapadali ng pagsasabog (ang aktibong transportasyon ay posible para sa glutamate) at pumapasok sa dugo mula sa mga tisyu. Ang pangunahing nagbibigay ng mga tisyu: at ang glutamine ay ang mga kalamnan, utak at atay. Sa daloy ng dugo, ang glutamine ay dinadala sa mga bituka at bato.
Sa mga selula ng bitukasa ilalim ng pagkilos ng enzyme glutaminase, ang hydrolytic release ng amide nitrogen sa anyo ng ammonia ay nangyayari:
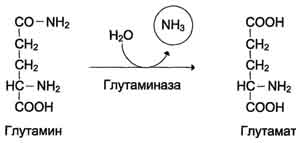
Ang glutamate na nabuo sa reaksyon ay sumasailalim sa transamination na may pyruvate. Ang pangkat ng os-amino na glutamic acid ay inilipat sa komposisyon ng alanine (Fig. 9-10). Ang mga malalaking halaga ng alanine ay pumapasok sa portal vein mula sa mga bituka at nasisipsip ng atay. Halos 5% ng nabuo ammonia ay tinanggal bilang bahagi ng feces, isang maliit na bahagi ang dumadaan sa portal vein sa atay, ang natitirang ~ 90% ay pinalabas ng mga bato.
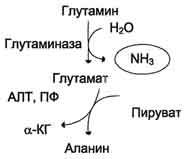
Sa batoang hydrolysis ng glutamine sa ilalim ng pagkilos ng glutaminase na may pagbuo ng ammonia ay nangyayari rin. Ang prosesong ito ay isa sa mga mekanismo ng regulasyon ng balanse ng acid-base sa katawan at pagpapanatili ng pinakamahalagang kation upang mapanatili ang osmotic pressure. Ang Renal glutaminase ay makabuluhang naapektuhan sa acidosis, ang nagresultang ammonia ay nag-neutralize ng acidic na mga produktong metaboliko at pinalabas sa anyo ng mga ammonium salts sa ihi (Fig. 9-11). Pinoprotektahan ng reaksyon na ito ang katawan mula sa labis na pagkawala ng mga ion ng Na + at K +, na maaari ring magamit upang maalis ang mga anion at mawala. Sa alkalosis, bumababa ang dami ng glutaminase sa mga bato.
Halos 0.5 g ng ammonium salts bawat araw ay nabuo at excreted sa mga bato.
Ang mataas na antas ng glutamine sa dugo at kadalian ng pagpasok nito sa mga cell ay natutukoy ang paggamit ng glutamine sa maraming mga proseso ng anabolic. Ang Glutamine ang pangunahing nitrogen donor sa katawan.Ang glutamine amide nitrogen ay ginagamit upang synthesize ang purines at pyrimidines.
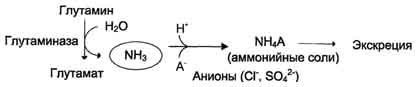
Fig. 9-11. Ang glutamine amide na metabolismo ng nitrogen sa mga bato.
nucleotides, asparagine, amino sugars at iba pang mga compound (Fig. 9-12).
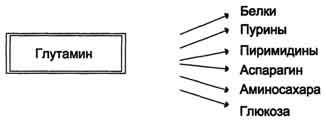
Ang isa pang reaksyon ng neutralisasyon ng ammonia sa mga tisyu ay maaaring isaalang-alang pagbubuo ng asparaginesa ilalim ng impluwensya ng asparagine synthetase.
Mayroong 2 isoform ng enzim na ito - ang glutamine-dependant at ammonia-dependant, na gumagamit ng iba't ibang mga donor ng mga grupo ng amide. Ang dating pag-andar sa mga cell ng hayop, ang huli ay namamayani sa mga selula ng bakterya, ngunit naroroon din sa mga hayop. Gayunpaman, ang pamamaraang ito ng pag-neutralize ng ammonia sa mga cell ng tao ay bihirang ginagamit at nangangailangan din ng mas maraming enerhiya (enerhiya ng dalawang bono ng macroergic) kaysa sa synthesis ng glutamine.
Ang pinaka makabuluhang halaga ng ammonia ay neutralisado sa atay sa pamamagitan ng synthesis ng urea.Sa unang reaksyon ng proseso, ang ammonia ay nagbubuklod sa carbon dioxide upang mabuo ang carbamoyl phosphate, at 2 ATP na mga molekula ay natupok. Ang reaksyon ay nangyayari sa mitochondria ng mga hepatocytes sa ilalim ng pagkilos ng enzyme carbamoylphosphate synthetase I. Carbamoylphosphate synthetase II ay naisalokal sa cytosol ng mga cell ng lahat ng mga tisyu at kasangkot sa synthesis ng gsrimidine nucleotides (tingnan ang seksyon 10). Ang Carbamoyl pospeyt ay pagkatapos ay isinalin sa ornithine cycle at ginamit upang synthesize ang urea.
Sa utak at ilang iba pang mga organo, maaari itong tumagas. muling pagbabalik sa amin α -ketoglutaratesa ilalim ng pagkilos ng glutamate dehydrogenase, na catalyzes isang reversible reaksyon. Gayunpaman, ang ganitong paraan ng pag-neutralize ng ammonia sa mga tisyu ay hindi maganda ginagamit, dahil ang glutamate dehydrogenase catalyzes higit sa lahat ang pagkamatay ng glutamate. Bagaman, isinasaalang-alang ang kasunod na pagbuo ng glutamine, ang reaksyon ay kapaki-pakinabang para sa mga cell, dahil itinataguyod nito ang pagbubuklod ng 2 NH 3 molekula nang sabay-sabay.
Mula sa mga kalamnan at bituka, ang labis na ammonia ay excreted higit sa lahat sa anyo ng alanine. Ang mekanismong ito ay kinakailangan, dahil ang aktibidad ng glutamate dehydrogenase sa mga kalamnan ay maliit at hindi direktang pagpapahina ng mga amino acid ay hindi epektibo. Samakatuwid, sa mga kalamnan ay may isa pang paraan ng pag-aalis ng nitrogen. Ang pagbuo ng alanine sa mga organo na ito ay maaaring kinakatawan ng mga sumusunod na pamamaraan (tingnan ang scheme sa ibaba).
Ang mga grupo ng mga Amino ng iba't ibang mga amino acid ay inilipat sa pamamagitan ng transamination sa pyruvate, ang pangunahing mapagkukunan ng kung saan ay ang proseso ng oksihenasyon ng glucose.
Ang mga kalamnan ay nagtatago ng maraming alanine dahil sa kanilang malaking masa at aktibong pagkonsumo.
Scheme
glucose sa panahon ng pisikal na gawain, at dahil din sa bahagi ng enerhiya na nakukuha nila dahil sa pagkasira ng mga amino acid. Ang nagreresultang alanine ay pumapasok sa atay, kung saan sumasailalim ito ng hindi tuwirang deamination. Ang pinalabas na ammonia ay neutralisado, at ang pyruvate ay kasama sa gluconeogenesis. Ang glucose mula sa atay ay pumapasok sa mga tisyu at doon, sa proseso ng glycolysis, ay muling na-oxidized sa pyruvate (Fig. 9-13).
Ang pagbuo ng alanine sa mga kalamnan, ang paglipat nito sa atay at ang paglipat ng glucose na synthesized sa atay pabalik sa mga kalamnan na bumubuo glucose-alanine cycle,na ang trabaho ay nauugnay sa gawain ng glucose-lactate cycle (tingnan ang seksyon 7).
Ang hanay ng mga pangunahing proseso ng metabolismo ng ammonia sa katawan ay iniharap sa Fig. 9-14. Ang glutamate dehydrogenase at glutamine synthetase ay ang nangingibabaw na mga enzyme sa pagpapalitan ng ammonia.
B. cycle ng Ornithine
Ang Urea ay pangunahing produkto ng pagtatapos ng metabolismo ng nitrogen,sa komposisyon kung saan hanggang sa 90% ng lahat ng excreted nitrogen ay pinakawalan mula sa katawan (Fig. 9-15). Ang uric excretion ay karaniwang ∼25 g / araw.
Sa pamamagitan ng isang pagtaas sa dami ng protina na natupok sa pagkain, ang urea excretion ay nagdaragdag. Ang Urea ay synthesized lamang sa atay, na itinatag sa mga eksperimento ng I.D. Pavlova. Ang pinsala sa atay at isang paglabag sa synthesis ng urea ay humantong sa isang pagtaas sa nilalaman ng ammonia at amino acid (pangunahing glutamine at alanine) sa dugo at tisyu.
Noong ika-40 taon ng siglo XX, itinatag ng Aleman na biochemists na si G. Krebs at K. Henseleit na ang synthesia ng urea ay isang proseso ng siklo na binubuo ng ilang mga yugto, ang pangunahing tambalan kung saan ang pagsasara ng ikot ay ornithine. Samakatuwid, ang proseso ng urea synthesis ay tinatawag "ornithine cycle"o "Krebs-Hanseleit cycle".
1. Mga reaksyon ng Urea synthesis
Urea (urea) - isang kumpletong amide ng carbonic acid - naglalaman ng 2 nitrogen atoms. Pinagmulan
isana kung saan ay ammoniana sa atay ay nagbubuklod sa carbon dioxide upang mabuo
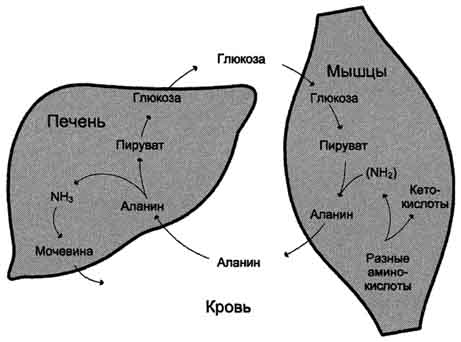
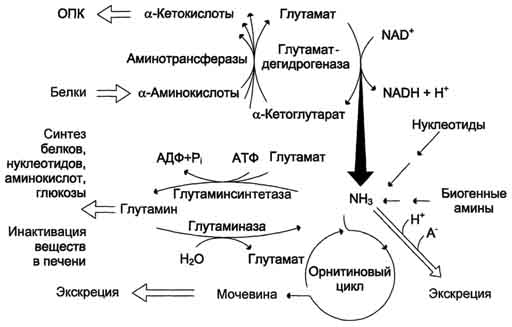
Fig. 9-14. Ang pagpapalitan ng ammonia. Ang pangunahing mapagkukunan ng ammonia ay mga amino acid. Karamihan sa nabuo ammonia ay neutralisado sa ornithine cycle sa atay at pinalabas bilang urea. Ang pangunahing reaksyon ng pag-neutralize ng ammonia sa mga tisyu ay ang synthesis ng glutamine, na pagkatapos ay ginagamit sa mga proseso ng anabolic at para sa neutralisasyon ng mga sangkap sa atay. Ang mga enzymes glutamate dehydrogenase at glutamine synthetase ay regulasyon at matukoy ang rate ng pagbuo at neutralisasyon ng ammonia.
carbamoyl pospeyt sa ilalim ng pagkilos ng carbamoyl phosphate synthetase I (tingnan ang Scheme A sa ibaba).
Sa sumusunod na reaksyon, ang argininosuccinate synthetase ay nagbubuklod sa citrulline na may aspartate at bumubuo argininosuccinate (argininosuccinic acid). Ang enzyme na ito ay nangangailangan ng Mg 2+ ion. Ang 1 mol ng ATP ay natupok sa reaksyon, ngunit ginagamit ang enerhiya ng dalawang mga macroergic bond. Aspartate - ang mapagkukunan ng pangalawang urea nitrogen atom(tingnan ang Scheme A sa pahina 483).
Scheme A
Scheme B
Ang Arginine ay sumasailalim sa hydrolysis sa ilalim ng pagkilos ng arginase, kasama ang pagbuo ng ornithine at urea. Ang mga Cactactors ng arginase ay Ca 2+ o Mn 2+ ion. Ang mataas na konsentrasyon ng ornithine at lysine, na kung saan ay mga istruktura na analogues ng arginine, pinipigilan ang aktibidad ng enzyme na ito:
Ang nagreresultang ornithine ay nakikipag-ugnay sa bagong molekula ng karbamoyl pospeyt, at natapos ang siklo.
Ang unang dalawang reaksyon ng proseso ay nangyayari sa mitochondria ng mga hepatocytes. Pagkatapos, ang citrulline, na isang produkto ng mga reaksyong ito, ay dinadala sa cytosol, kung saan isinasagawa ang karagdagang mga pagbabagong-anyo (Fig. 9-16).
Ang kabuuang equation para sa synthesis ng urea:
СО 2 + NH 3 + Aspartate + 3 ATP + 2 Н 2 О → Urea + Fumarate + 2 (ADP + Н 3 Р0 4) + AMP + H 4 P 2 O 7.
Ang ammonia na ginagamit ng carbamoylphosphate synthetase I ay ibinibigay sa atay na may dugo mula sa portal vein. Ang papel na ginagampanan ng iba pang mga mapagkukunan, kabilang ang mabilis na deamination ng glutamine eta sa atay, ay mas mababa.
Aspartate, kinakailangan para sa synthesis ng argininocinate, ay nabuo sa atay sa pamamagitan ng transamination.
Scheme B
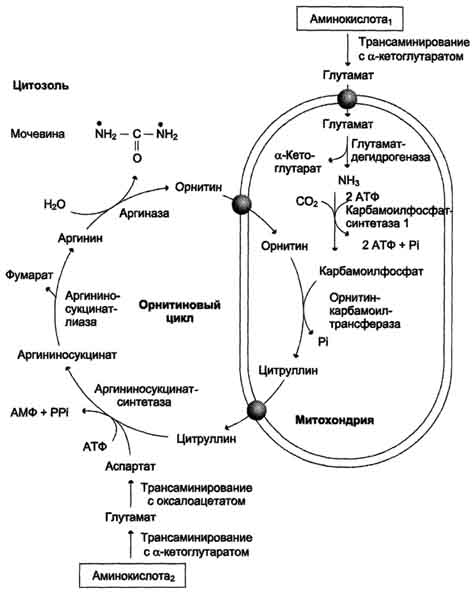
Fig. 9-16. Krebs-Hanseleit Ornithine cycle. Ang Oxidative deamination ng glutamate ay nangyayari sa mitochondria. Ang mga enzyme ng ornithine cycle ay ipinamamahagi sa pagitan ng mitochondria at cytosol. Samakatuwid, ang paglilipat ng transembrane ng glutamate, citrulline at ornithine sa tulong ng mga tukoy na translocases ay kinakailangan. Ipinapakita ng diagram ang mga landas para sa pagsasama ng nitrogen ng dalawang magkaibang mga amino acid (amino acid 1 at amino acid 2) sa molekula ng urea: • isang pangkat ng amino - sa anyo ng ammonia sa mitochondrial matrix; • Ang pangalawang pangkat ng amino ay ibinibigay ng cytosol aspartate.
alanine na may oxaloacetate. Ang Alanya ay pangunahing mula sa mga kalamnan at mga cell ng mga bituka. Ang mapagkukunan ng oxaloacetate na kinakailangan para sa reaksyong ito ay maaaring isaalang-alang ang pagbabalik ng fumarate na nabuo sa mga reaksyon ng ornithine cycle. Bilang isang resulta ng dalawang reaksyon ng citrate cycle, fumarate ay na-convert sa oxaloacetate, mula sa kung saan ang aspartate ay nabuo sa pamamagitan ng transamination (Fig. 9-17). Kaya, sa ornithine cycle ay ipinares ispartate ang pagbabagong-buhay ng ikot mula sa fumarate.Ang pyruvate, na nabuo mula sa alanine sa siklo na ito, ay ginagamit para sa gluconeogenesis.
Ang isa pang mapagkukunan ng aspartate para sa ornithine cycle ay ang transamination ng glutamate na may oxaloacetate.
2. Ang balanse ng enerhiya ng proseso
Apat na macroergic bond ng tatlong molekula ang natupok sa mga reaksyon ng ornithine cycle
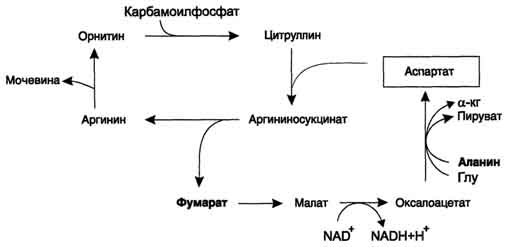
Ang ATP para sa bawat rebolusyon ng ikot. Gayunpaman, ang proseso ng pag-convert ng mga amino acid sa mga residue na walang nitrogen at ang urea ay may mga paraan upang mabayaran ang mga gastos sa enerhiya:
- kapag ang fumarate ay kasama sa CCC, sa yugto ng malate dehydrogenation, nabuo ang NADH, na nagsisiguro sa synthesis ng 3 ATP molecules (Fig. 9-18);
- sa panahon ng oxidative deamination ng glutamate sa iba't ibang mga organo, ang NADH ay nabuo din, ayon sa pagkakabanggit - isa pang 3 molekula ng ATP.
Mga gastos sa enerhiyanagaganap din sa panahon ng transportembrane transport ng mga sangkap na nauugnay sa synthesis at excretion ng urea (Fig. 9-18). Ang unang dalawang reaksyon ng ornithine cycle ay nangyayari sa mitochondria, at ang susunod na tatlo sa cytosol. Ang Citrulline na nabuo sa mitochondria ay dapat ilipat sa cytosol, at ang ornithine na nabuo sa cytosol ay dapat na dalhin sa mitochondria. Bilang karagdagan, sa mga bato, ang paglipat ng urea mula sa dugo sa ihi ay nangyayari sa pamamagitan ng aktibong transportasyon dahil sa gradient ng sodium ion na nilikha ng K +, Na + -ATPase, na nauugnay din sa pagkonsumo ng enerhiya.
Ang isang kumpletong hanay ng mga ornithine cycle enzymes ay matatagpuan lamang sa mga hepatocytes. Ang mga hiwalay na mga enzyme ng ornithine cycle ay matatagpuan hindi lamang sa atay, kundi pati na rin sa iba pang mga cell. Ang mga enterocytes, halimbawa, ay mayroong syntamase ng carbamoylphosphate I at ornithinecarbamoyl transferase, samakatuwid, ang citrulline ay maaaring synthesized. Ang argininosuccinate synthetase at argininosuccinate lyase ay natagpuan sa mga bato. Ang Citrulline na nabuo sa mga enterocytes ay maaaring makapasok sa mga bato at magpunta doon sa arginine, na dinala sa atay at na-hydrolyzed ng arginase. Ang aktibidad ng mga enzymes na nagkalat sa iba't ibang mga organo ay mas mababa kaysa sa atay.
3. Ang biological na papel ng siklo ng ornithine
Krebs-Hanseleit
Ang ornithine cycle sa atay ay gumaganap ng 2 function:
- ang pag-convert ng nitrogen ng mga amino acid sa urea, na kung saan ay excreted at pinipigilan ang akumulasyon ng mga produktong nakakalason, pangunahin ang ammonia;
- synthesis ng arginine at muling pagdadagdag ng pondo nito sa katawan.
Ang mga yugto ng regulasyon ng proseso ay ang synthesis ng carbamoyl pospeyt, ang synthesis ng citrulline at ang pangwakas na yugto, na napalaki ng arginase. Ang bisa ng ornithine cycle na may normal na nutrisyon ng tao at katamtaman na pisikal na bigay ay humigit-kumulang na 60% ng kapangyarihan nito. Kinakailangan ang reserba ng kuryente upang maiwasan ang hyperammonemia na may mga pagbabago sa dami ng protina sa pagkain. Ang isang pagtaas sa rate ng urea synthesis ay nangyayari sa matagal na pisikal na gawain o matagal na gutom, na sinamahan ng pagbagsak ng mga protina ng tisyu. Ang ilang mga kondisyon ng pathological na nailalarawan sa pamamagitan ng matinding pagsira ng protina
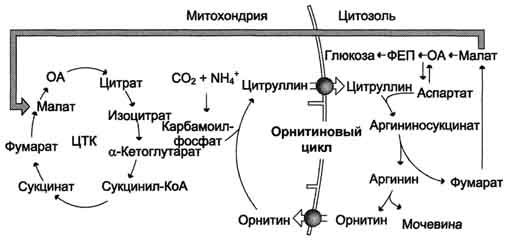
Fig. 9-18. Ang relasyon ng ornithine cycle at ang pangkalahatang landas ng catabolism. Ang fumarate na nagreresulta mula sa cleavage ng argininosuccinate ay na-convert sa malate, na pagkatapos ay ilipat sa mitochondria, ay isinasama sa CTK at dehydrogenated upang mabuo ang oxaloacetate. Ang reaksyon na ito ay sinamahan ng pagpapalabas ng 3 ATP molekula, na magbayad para sa pagkonsumo ng enerhiya para sa pagbubuo ng isang molekula ng urea.
mga tisyu (diabetes mellitus, atbp.) Sinamahan din ng pag-activate ng siklo ng ornithine. Sa labis na nutrisyon ng protina, ang bilang ng mga enzim na cycle ng ornithine sa pagtaas ng atay, na humantong sa isang pagtaas ng synthesis ng urea.
4. Hyperammonemia
Ang pagkagambala ng mga reaksyon ng neutralization ng ammonia ay maaaring maging sanhi nadagdagan ang ammonia sa dugo- hyperammonemia, na may nakakalason na epekto sa katawan. Ang mga sanhi ng hyperammonemia ay maaaring isang genetic na depekto ng mga enzymes ng ornithine cycle sa atay, at pangalawang pinsala sa atay bilang isang resulta ng cirrhosis, hepatitis at iba pang mga sakit. Limang namamana sakit ay kilala, sanhi ng isang depekto sa limang mga enzymes ng ornithine cycle (Talahanayan 9-4).
Sa panitikan, ang mga kaso ng lahat ng mga bihirang bihirang mga enzymes na ito ay inilarawan, na kung saan ang pinakamaraming kaso ng uri II hyperammonemia ay nabanggit.
Ang paglabag sa ornithine cycle ay sinusunod na may hepatitis ng iba't ibang mga etiologies at ilang iba pang mga sakit na viral. Halimbawa, natagpuan na ang mga virus ng trangkaso at iba pang mga talamak na impeksyon sa virus sa paghinga ay binabawasan ang aktibidad ng carbamoylphosphate synthetase I. Ang Hyperammonemia ay madalas ding sinusunod sa cirrhosis at iba pang mga sakit sa atay.
Ang isang pagbawas sa aktibidad ng anumang urea synthesis enzyme ay humahantong sa akumulasyon sa dugo ng substrate ng enzyme at mga nauna nito. Kaya, na may isang depekto sa argininosuccinate synthetase, ang nilalaman ng citrulline ay nagdaragdag (citrullineemia); na may depekto sa arginase - ang konsentrasyon ng arginine, argininosuccinate, citrulline, atbp. Sa uri I at type II hyperammonemia, ang carbamoyl phosphate ay nag-iipon sa mitochondria at lumabas sa cytosol dahil sa ornithinecarbamoyltransferase na depekto. Nagdudulot ito ng isang pagtaas sa rate ng synthesis ng pyrimidine nucleotides (dahil sa pag-activate ng carbamoylphosphate synthetase II), na humahantong sa akumulasyon ng orotate, uridine at uracil at ang kanilang paglabas sa ihi. Ang nilalaman ng lahat ng mga metabolite ay nagdaragdag, at ang kondisyon ng mga pasyente ay lumala sa pagtaas ng dami ng protina sa pagkain. Ang kalubhaan ng kurso ng sakit ay nakasalalay din sa antas ng pagbaba ng aktibidad ng enzyme.
Ang lahat ng mga karamdaman ng siklo ng ornithine ay humantong sa isang makabuluhang pagtaas sa konsentrasyon ng ammonia, glutamine at alanine sa dugo.
Hyperammonemiasinamahan ng hitsura ng mga sumusunod na sintomas:
- pagduduwal, paulit-ulit na pagsusuka;
- pagkahilo, kombulsyon;
- pagkawala ng kamalayan, tserebral edema (sa mga malubhang kaso);
- mental retardation (sa talamak na form ng congenital).
Talahanayan 9-4. Ang mga karamdaman ng heneralidad ng siklo ng ornithine at ang kanilang pangunahing pagpapakita
| Ang sakit | Pang-apekto enzyme |
Uri ng pamana | Klinikal mga paghahayag |
Metabolites | |
| dugo | ihi | ||||
| Hyperam- moniemia type ko |
Carbamoyl pospeyt synthetase ko |
Autosomal pag-urong |
Sa loob ng 24-48 na oras pagkatapos ng kapanganakan ng isang pagkawala ng malay, kamatayan | Si Gln Ala NH 3 |
Orotat |
| Hyperam- moniemia uri II |
Ornithine karbamoyl transferase |
Naka-link na X | Ang hypotension, nabawasan ang tolerance ng protina | Si Gln Ala NH 3 |
Orotat |
| Citrul linemia |
Arginine succinate synthetase |
Autosomal pag-urong |
Malala ang Hyperammonemia sa mga bagong silang. Sa mga matatanda - pagkatapos ng pag-load ng protina | Citrulline NH 3 |
Citrulline |
| Arginine succin turia |
Arginine succinate lyase |
Autosomal urong | Hyperammonium, ataxia, kombulsyon, pagkawala ng buhok | Argini nosuccinate NH 3 |
Argini nosucci nat, Gln, Ala, Liz |
| Hyperrar gininemia |
Arginase | Autosomal urong | Hyperargininemia | Abr NH 3 |
Abr Liz Ornithine |
Ang lahat ng mga sintomas ng hyperammonemia ay isang pagpapakita ng pagkilos ng ammonia sa central nervous system (tingnan ang subseksyon IV, B sa itaas).
Para sa pagsusuri ng iba't ibang uri ng hyperammonemia, ang nilalaman ng ammonia sa dugo, metabolites ng ornithine cycle sa dugo at ihi, at ang aktibidad ng enzyme sa mga biopsies sa atay ay natutukoy.
Ang pangunahing sintomas ng diagnostic aynadagdagan ang konsentrasyon ng ammonia sa dugo. Ang nilalaman ng ammonia sa dugo ay maaaring umabot sa 6000 μmol / L (normal - 60 μmol / L). Gayunpaman, sa karamihan ng mga talamak na kaso, ang antas ng ammonia ay maaari lamang tumaas pagkatapos ng pag-load ng protina o sa panahon ng talamak na kumplikadong mga sakit.
Paggamotang mga pasyente na may iba't ibang mga depekto ng siklo ng ornithine ay pangunahing naglalayong bawasan ang konsentrasyon ng ammonia sa dugo dahil sa isang diyeta na may mababang protina, na nagpapakilala sa mga keto analogs ng mga amino acid sa diyeta at pinasisigla ang pag-aalis ng ammonia na pumapalag sa mga nabalisa na mga reaksyon:
- sa pamamagitan ng pagbubuklod at pag-aalis ng NH 3 sa komposisyon ng phenylacetylglutamine at histuric acid;
- isang pagtaas sa konsentrasyon ng mga intermediate na metabolites ng siklo (arginine, citrulline, glutamate) na nabuo sa labas ng mga naharang na reaksyon (Fig. 9-19).
Ang Phenylacetate, pinamamahalaan sa isang pasyente na may kakulangan sa carbamoylphosphate synthetase I bilang isang suplemento sa pagkain, na bumubuo ng phenylacetylglutamine, na kung saan ay pinalabas ng mga bato bilang isang resulta ng pagbagsak nito sa glutamine. Kasabay nito, ang kondisyon ng mga pasyente ay nagpapabuti, dahil ang synthesis ng glutamine ay isinaaktibo at ang konsentrasyon ng ammonia sa dugo ay bumababa (Fig. 9-19, A).
Ang isang katulad na epekto ay isinagawa ng pagpapakilala ng benzoate, na nagbubuklod ng isang molekula ng glycine. Ang nagresultang asido ng asido ay excreted sa ihi (Fig. 9-19, B). Bilang bahagi ng hippurate, ang nitrogen ay pinalaya mula sa katawan. Ang kakulangan sa glycine ay binabayaran alinman sa synt synthes mula sa serine, o dahil sa pagbuo ng NH 3 at CO 2 sa reaksyon na napalaki ng glycine synthetase. Sa kasong ito, ang pagbuo ng glycine ay sinamahan ng pagbubuklod ng isang molekula ng ammonia.
Sa uri II hyperammonemia (ornithinecarbamoyltransferase defect), ang pagpapakilala ng malaki
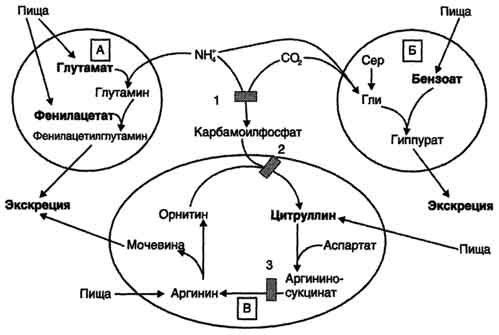
Fig. 9-19. Ang mga paraan upang alisin ang ammonia kapag ang glutamate at phenylacetate (A), benzoate (B), citrulline at arginine (C) ay kasama sa diyeta. Ang figure ay nagpapakita ng mga bloke ng enzyme: 1 - defect carbamoylphosphate synthetase I; 2-depekto ornithinecarbamoyltransferase; 3 - depekto argininosuccinate lyase.
ang mga dosis ng citrulline ay pinasisigla ang synthesis ng urea mula sa aspartate (Fig. 9-19, B), na humahantong din sa pagsipsip ng nitrogen mula sa katawan. Ang pagpapakilala ng malalaking dosis ng arginine sa argininosuccinaturia (isang depekto sa argininosuccinate lyase) ay pinasisigla ang pagbabagong-buhay ng ornithine at nitrogen excretion bilang bahagi ng citrulline at argininosuccinate.
D. Pagpapalit ng ammonia at amino acid sa pagitan ng mga organo at tisyu
Maraming mga tisyu ang kasangkot sa catabolism ng mga amino acid at pagbuo ng ammonia. Ang amonia ay nagbubuklod sa mga selula. Ang Nitrogen ay excreted mula sa katawan ng mga bato sa anyo ng dalawang dulo ng mga produkto ng metabolismo ng nitrogen - ammonium salts (~ 0.5 g / day), na nabuo sa mga bato, at urea (~ 25 g / araw), na naglalaman ng hanggang sa 90% ng excreted nitrogen. Ang Urea ay synthesized sa atay sa ornithine cycle, at 1 mol ng ammonia at 1 mol ng aspartic acid ay ginagamit upang bumuo ng 1 nunal ng urea. Kaya, ang 6.3 g ng ammonia at 50 g ng aspartate ay natupok para sa synthesis ng 25 g ng urea bawat araw. Ang mga espesyal na mekanismo ay dapat gumana nang masidhi upang maihatid ang nitrogen sa atay.
Ang transportasyon ng nitrogen mula sa mga tisyu hanggang sa ataynangyayari sa pangunahin sa komposisyon ng 3 compound: glutamine, alanine, ammonia (isang maliit na halaga sa isang walang batayang form).
Bilang karagdagan sa glutamine at alanine, ang iba pang mga libreng amino acid ay naroroon sa dugo, at ang kanilang nilalaman at direksyon ng transportasyon ay nakasalalay sa paggamit ng pagkain at ang paggamit ng mga endogenous protein. Ang pinakamalaking halaga ng mga libreng amino acid ay nagmula sa mga kalamnan at bituka, na may hanggang sa 50% na alanine at glutamine. Mayroong isang direksyon na daloy ng mga amino acid mula sa mga tisyu na ito sa atay, na nagdaragdag sa panahon ng pagsipsip na may nutrisyon ng protina.
Karamihan sa glutamine ay inihatid sa dugo. kalamnan at utak.Mula sa daloy ng dugo, ito ay hinihigop ng atay at bato, kung saan nakalantad sa glutaminase. Bato- ang pangunahing mapagkukunan ng serine at bahagyang alanine, na kung saan ay sorbed mula sa plasma ng atay. Ang utakhindi katulad ng lahat ng iba pang mga tisyu, nagagawa nitong sumipsip at mag-oxidize ng malaking halaga ng branched-chain amino acid (valine, leucine, isoleucine).
Pagkatapos kumain mula satumatanggap ng maraming mga amino acid, ang mga bituka sa plasma ng dugo, at
branched side chain amino acid namamayani (hanggang sa 20% ng kabuuang), na kung saan ay pagkatapos ay nasisipsip pangunahin ng atay, kalamnan at utak (Fig. 9-20). Sa mga kalamnan, ang pinahusay na catabolism ng mga amino acid na ito ay nangyayari, at kumikilos sila bilang pangunahing donor ng pangkat ng amino sa synthesis ng alanine mula pyruvate (tingnan sa itaas ng "glucose-alanine cycle").
Sa panahon ng postabsorptionang pangunahing mapagkukunan ng mga libreng amino acid ay kalamnan. Ang mga ito ay nagbibigay ng pangunahing alanine at glutamine (Larawan 9-21). Ang Alanine ay nasisipsip ng atay, glutamine - ng mga bituka at bato. Sa bituka, ang glutamine nitrogen ay inilipat sa alanine o isang serye at sa kanilang komposisyon ay inihatid sa atay, kung saan ang proseso ng gluconeogenesis. Ang intensity ng gluconeogenesis mula sa mga amino acid ay mas mataas kaysa sa lahat ng iba pa. Kaya, ang alanine at serye ay ang pangunahing glycogenic amino acid. Ang mga branched chain amino acid (valine, leucine, isoleucine, atbp.), Na pinakawalan mula sa mga kalamnan, ay ipinadala sa utak, kung saan sila ay na-oxidized at nagsisilbing isang mahalagang mapagkukunan ng enerhiya.
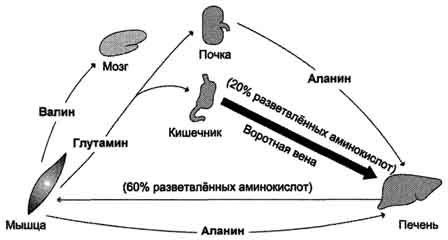
Fig. 9-20. Ang pagpapalitan ng mga amino acid sa pagitan ng mga tisyu at mga organo sa panahon ng pagsisipsip. Sa panahon ng pagsisipsip, ang bituka ay ang pangunahing mapagkukunan ng mga libreng amino acid. Karamihan sa mga papasok na amino acid ay branched hydrophobic amino acid. Ang exogenous polar amino acid mula sa portal vein ay sorbed at ginagamit pangunahin ng atay. Ang mga branched amino acid ay nasisipsip mula sa daloy ng dugo ng mga selula ng utak o kalamnan.
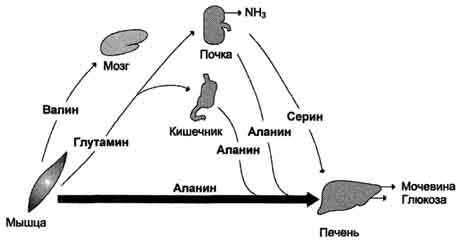
Fig. 9-21. Ang pagpapalitan ng mga amino acid sa pagitan ng mga tisyu at mga organo sa postabsorption period. Sa panahon ng postabsorption, ang mga libreng amino acid ay pangunahin mula sa mga kalamnan kung saan ang protina na catabolism ay pinahusay. Ang mga amino acid ay ginagamit sa gluconeogenesis sa atay. Ang mga antas ng dugo ng alanine, serine at glutamine ay nakataas.
