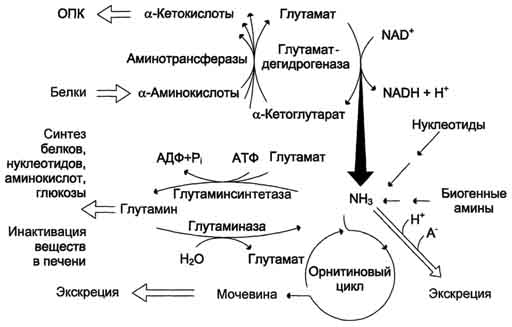
Glavni mehanizam za neutralizaciju amonijaka u tijelu je biosinteza uree. Potonji se izlučuje u urinu kao glavnom krajnjem proizvodu proteina, odnosno aminokiselina, metabolizma. Urea čini do 80-85% ukupnog azota u urinu. Glavno i možda jedino mjesto sinteze uree je jetra. G. Krebs i K. Hanselyight po prvi put su 1932. godine izvukli jednadžbe za reakcije sinteze uree, koje su predstavljene u obliku ciklusa, nazvane u literaturi krebsov ciklus uree ornitina.
Treba napomenuti da je u biohemiji to bio prvi ciklički metabolički sustav, čiji je opis gotovo 5 godina utvrđen otkrićem G. Krebsa još jednog metaboličkog procesa - ciklus trikarboksilne kiseline. Daljnja ispitivanja uvelike su potvrdila cikličku prirodu biosinteze uree u jetri. Zahvaljujući istraživanju G. Cohen, S. Ratner i sur. razjašnjeni su intermedijarni koraci i enzimski sustavi koji kataliziraju stvaranje uree.
Stoga se cijeli ciklus uree može prikazati na sljedeći način. U prvoj fazi se sintetiše makroergično jedinjenje karbamoil fosfat - metabolički aktivni oblik amonijaka koji se koristi kao polazni proizvod za sintezu nukleotida pirimidina (DNK i RNA, respektivno) i arginina (proteina i uree, respektivno):
Urea je glavni krajnji produkt metabolizma dušika, u čijem sastavu se izlučuje višak azota iz organizma.
Ciklus ornitina u jetri obavlja dvije funkcije:
Konverzija aminokiselina u ureu koja se izlučuje i sprečava nakupljanje toksičnih proizvoda, uglavnom amonijaka;
Sinteza arginina i nadopunjavanje njegovog fonda u tijelu.
Razmotrimo ciklus uree:
![]()
Slika 34 - Sinteza ornitina uree u jetri
Počinje stvaranjem karbamoil fosfata u mitohondrijama, gdje ima puno ATP-a.
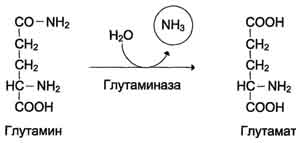
1 Stvaranje karbamoil fosfata. Amonijevi ioni nastali oksidativnim deaminacijom glutaminske kiseline stupaju u interakciju sa bikarbonatnim anionom i ATP-om uz učešće karbamoilfosfat sintetaze, formirajući karbamoilfosfat koji sadrži makroergičku vezu:
NN 4 + + NOS 3 - + 2ATF → N 2 N - S + 2ADF + N 2 R 4 - + N +
Karbamoil fosfat
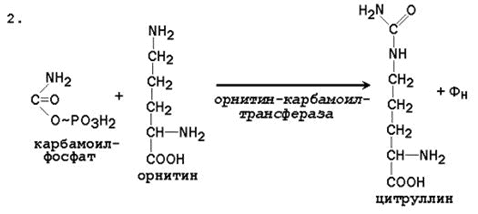
2. Dobijanje citrulina. U mitohondrijalnom matriksu karbamoil fosfat se kondenzira sa aminokiselinom ornitin, koji, kao homolog lizina, nije dio proteina.
Reakcija je katalizirana ornitinkarbamoiltransferazom:
O SOO - O N СОO -
S + N 2 N - S → SO + N 2 RO 4 -
+ / \ + \ + / \ ||
N 3 N (SN 2) 3 NN 3 O ~ F H3 N (CH2) 3 NH-C-NH2
Ornitin karbamoil fosfat citrulin
Rezultirajući citrulin prelazi u citozol ćelija jetre gdje se pojavljuju ostatak reakcije urea-ciklusa.
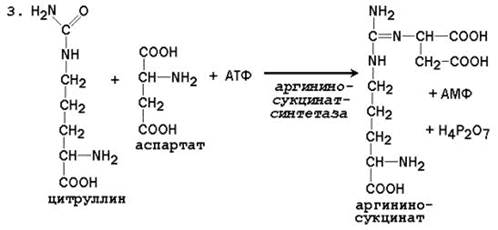
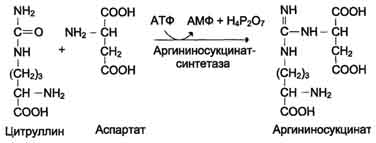
3. Dobijanje arginin sukcinata. Zamjena karbonilne skupine citrulina amino skupinom aspartata stvaranjem gvanidinske grupe argininosukcinatom događa se uz sudjelovanje ATP-a i katalizira ga argininosukcinat sintetazom:
N SOO - N SOO -
C O + C + ATP →
N 3 N (SN 2) 3 NN - S - NN 2 N 3 N SN 2 SOO -
Citrulin Aspartat
S N 2 N SN 2 SOO - + N 2 R 2 O 7 2- + AMP
N 3 N (SN 2) 3 NN - S - NN - SNSO -
Arginosukcinat
Reakcija je energetska; tokom prve i treće reakcije u ciklusu se troše 4 ATP molekule.
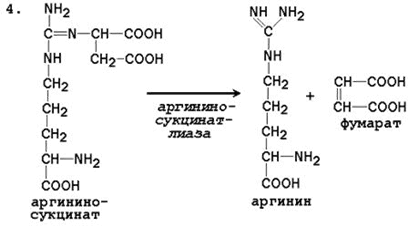
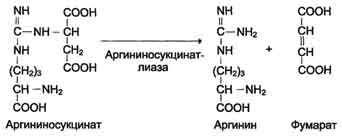
4. Raspad arginina sukcinat. Pod dejstvom argininosukcinatne lize argininosukcinat eksergonski se razlaže s stvaranjem arginina i fumarata:
N SOO - N SOO - SOO - N
S N 2 N SN 2 SOO - → S N 2 N + S \u003d S
+ / \ || | + / \ || / \
N 3 N (SN 2) 3 NN - S - NN - SNSO - N 3 N (SN 2) 3 NN - S - NH 2 N SOO -
Arginin Sukcinat Arginin Fumarat
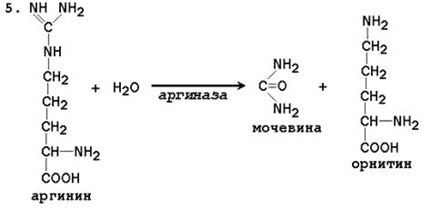
5. Formiranje uree i regeneracija ornitina. Hidroliza arginina, katalizirana arginazom, dovodi do stvaranja uree i regeneracije ornitina. Reakcija je ekstrogonska.
N SOO - N SOO - NN 2
S N 2 N → S + O \u003d S
+ / \ || + / \ + \
H3 N (CH2) 3 NH - C - NH2H3N (CH2) 3 NH3 NH2
Arginin Ornitin Urea
Regenerirani ornitin može opet ući u mitohondrije i učestvovati u novom prometu urea-ciklusa. Krv prenosi ureu koja se formira iz jetre do bubrega, gdje se ona vadi iz krvi i uklanja mokraćom iz tijela.
U ornitinskom ciklusu se troše 4 makroergične veze od tri ATP molekule za svaku obrtaju ciklusa.
Međutim, proces stvaranja uree pruža sebi energiju:
Za vrijeme regeneracije aspartata iz fumarata, NADH nastaje u fazi dehidrogeniranja malata što može osigurati sintezu 3 makroergičke veze.
Za vrijeme oksidacijskog razgradnje glutamata, NADH se također formira u različitim organima koji mogu osigurati sintezu 3 makroergične veze.
Iz gornjih reakcija se vidi da se toksični amonijak pretvara u bezopasnu ureu. U ovom slučaju jedan od atoma azota uree nastaje iz amonijaka, a drugi iz aspartata.
24.4.1. Biosinteza uree- glavni način neutralizacije amonijaka. Urea se sintetiše u ciklusu ornitina u ćelijama jetre. Ovu reakcijsku sekvencu otkrili su H. Krebs i K. Hanseleit 1932. Prema modernim konceptima, ciklus uree uključuje niz od pet reakcija.
Dvije početne reakcije biosinteze uree pojavljuju se u mitohondrijama jetrenih stanica.
Naknadne reakcije odvijaju se u citoplazmi ćelija jetre.
Opća shema ornitinskog ciklusa prikazana je na slici 24.2:
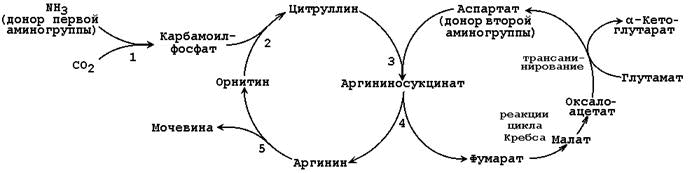
Slika 24.2.Šema ciklusa ornitina i njegova veza s konverzijama fumarne i aspartanske kiseline.
Brojevi označavaju enzime koji kataliziraju reakcije ornitinskog ciklusa: 1 - karbamoilfosfat sintetaza; 2 - ornitin karbamoiltransferaza; 3 - argininosukcinat sintetaza; 4 - argininosukcinat; 5 - arginaza.
24.4.2. Ciklus ornitina je blizu veza sa ciklusom trikarboksilne kiseline:
- pokretačke reakcije urea-ciklusa kao i reakcije CTK-a odvijaju se u mitohondrijskom matriksu;
- opskrba CO2 i ATP-a, potrebnih za stvaranje ureje, osigurava se djelovanjem CTK-a;
- u urea ciklusu nastaje fumarat, koji je jedan od supstrata CTK-a. Fumarati hidrate do malata koji se oksidira u oksaloacetat. Oksaloacetat može proći transaminaciju u aspartat; ova aminokiselina je uključena u nastanak arinosukcinata.
24.4.3. Regulacija aktivnosti enzima ciklus se provodi uglavnom na razini karbamoilfosfat sintetaze, koja je neaktivna u nedostatku njegovog alosternog aktivatora - N-acetil-glutamat. Koncentracija potonjeg zavisi od koncentracije njegovih prekursora (acetil-CoA i glutamata), kao i arginina, koji je alosterni aktivator N-acetilglutamat sintaze:
Acetil-CoA + glutamatN-acetilglutamat + CoA-SH
Koncentracija enzima u ornitinskom ciklusu zavisi od sadržaja proteina u ishrani. Kada pređu na dijetu bogatu proteinima, sinteza enzima iz ornitinskog ciklusa se povećava u jetri. Po povratku na uravnoteženu prehranu, koncentracija enzima se smanjuje. U uvjetima gladovanja, kada se pojača razgradnja tkivnih proteina i upotreba aminokiselina kao energetskih supstrata, povećava se proizvodnja amonijaka, povećava se koncentracija enzima iz ornitinskog ciklusa.
24.4.4. Poremećaji ornitinskog ciklusa. Metabolički poremećaji su poznati zbog djelomičnog blokiranja svakog od 5 enzima koji kataliziraju reakciju sinteze uree u jetri, kao i N-acetilglutamat sintaze. Ova genetska oštećenja su očigledno parcijalna. Čini se da je potpuna blokada bilo kojeg od stadijuma urea ciklusa u jetri nespojiva sa životom, jer ne postoji drugi efikasan način uklanjanja amonijaka.
Čest znak svih poremećaja sinteze uree je povećani sadržaj NH4 + u krvi ( hiperammonemija) Najteže kliničke manifestacije opažene su sa defektom enzima karbamoilfosfat sintetaza. Klinički simptomi zajednički za sve poremećaje urea ciklusa uključuju povraćanje, poremećenu motoričku koordinaciju, razdražljivost, pospanost i mentalnu retardaciju. Ako se bolest ne dijagnosticira, onda brzo slijedi smrt. Kod starije djece manifestacije bolesti su povećana ekscitabilnost, povećanje veličine jetre i odbojnost prema hrani s visokim udjelom proteina.
Laboratorijska dijagnostika bolesti uključuje utvrđivanje amonijaka i metabolita ornitinskog ciklusa u krvi, urinu i cerebrospinalnoj tečnosti; u teškim slučajevima pribegavaju biopsiji jetre.
Značajno poboljšanje uočeno je s ograničenjem proteina u ishrani, dok se mnogi poremećaji mozga mogu spriječiti. Dijeta sa malo proteina dovodi do smanjenja sadržaja amonijaka u krvi i do poboljšanja kliničke slike u blagim oblicima ovih nasljednih poremećaja. Hranu treba uzimati često, u malim porcijama, kako bi se izbjeglo naglo povećanje razine amonijaka u krvi.
24.4.5. Klinička i dijagnostička vrijednost određivanja uree u krvi i urinu. U krvi zdrave osobe sadržaj uree je 3,33 - 8,32 mmol / L. Za jedan dan s urinom se izluči 20 - 35 g uree.
Promjene uree u krvi u bolestima ovise o omjeru procesa njenog stvaranja u jetri i izlučivanja putem bubrega. Povećavanje urea u krvi (hiperazotemija) bilježi se s bubrežnim zatajenjem, smanjenje - sa zatajenjem jetre, uz dijetu koja sadrži malo proteina.
Pojačano izlučivanje mokraće sa urinom primjećuje se kod konzumiranja hrane s visokom količinom proteina, kod bolesti praćenih povećanim katabolizmom proteina u tkivima, uz istovremeno uzimanje određenih lijekova (na primjer, salicilata). Smanjenje izlučivanja uree mokraćom karakteristično je za bolesti i toksične lezije jetre, bolesti bubrega, praćene kršenjem njihove sposobnosti filtriranja.
Amonijak je jedan od konačnih proizvoda razmjene tvari koje sadrže dušik. Ovo je komponenta zaostale frakcije dušika u krvnom serumu (zajedno s ureom, mokraćnom kiselinom, kreatininom, indikanom). U krvi je koncentracija amonijaka niska - 25-40 mikromol / l. U većim koncentracijama ima toksičan učinak na organizam.
Amonijak je toksičan, prvenstveno za centralni nervni sistem. Otrovnost amonijaka povezana je s njegovom sposobnošću da poremeti funkcionisanje CLK-a, jer NH 3 uklanja CLK-ketoglutarat:
- KG + NH3 + NADH. H + Glu + OVER + + H 2 O.
Na kraju reduktivna aminacija - keto - glutarat, dolazi do smanjenja aktivnosti CLK u ćelijama centralnog nervnog sistema, što usput inhibira aktivnost aerobne oksidacije glukoze. Kao rezultat toga, proizvodnja energije je poremećena i razvija se hipoenergetsko stanje, jer glukoza je glavni izvor energije za mozak.
NH 3 formirana tokom sledećih procesa :
1) oksidativna deaminacija aminokiselina - ovo je glavni put proizvodnje NH 3;
deaminacija biogenih amina;
deaminacija purinskih baza (adenin, gvanin);
katabolizam nukleotida pirimidina.
U mozgu je glavni izvor nastajanja NH3 deaminacija AMP u inozin monofosfat (IMP):
AMP + H 2 Oh IMP +NH 3 .
Enzim koji katalizira ovu reakciju je adenozin deaminaza.
Amonijak se krvlju transportira do jetre i bubrega radi neutralizacije u sastavu aminokiselina, među kojima su glavne glutamin, asparagin, alanin.
Neutralizacija NH 3 događa se gotovo odmah nakon njegovog formiranja, jer u tkivima se odmah uključuje u sastav aminokiselina, uglavnom glutamina. Međutim, za daljnju detoksikaciju i eliminaciju amonijaka postoje biohemijski procesi u jetri i bubrezima, koji su glavni načini neutralizacije NH3.
Dodijelite sljedeće mehanizmi za dekontaminaciju NH 3 :
1 ) reduktivna aminacija -ketoglutarata;
2 ) stvaranje amida aminokiselina - asparagin i glutamin;
3 ) stvaranje amonijevih soli u bubrezima;
4 ) sinteza uree.
U tkivima, amonijak je podložan trenutnoj neutralizaciji. To se postiže kombinacijom procesa ( 1 ) i ( 2 ).
Redukciona aminacija –Ketoglutarat:
NH 3 + –KG + NADN . N + Glu + NAD + N 2 O.
Enzim - glutamat dehidrogenaza
Ovaj postupak zahtijeva značajne koncentracije - KG. Kako bi se izbjegli prekomjerni izdaci - KG i rad CLK-a nije poremetio, - KG se puni zbog konverzije PVKOA - KG.
2 )Formiranje amidaVažan je pomoćni mehanizam za neutralizaciju NH 3 u tkivima vezanjem na Glu ili Asp.
Asp + ATP +NH 3 ASN + AMP + FF nn
Enzim - asparagin sintaza
Glu + ATP +NH 3 Gln + AMP + FF nn
Enzim - glutamin sintaza
Ovaj proces je najaktivniji u centralnom nervnom sistemu, mišićima, bubrezima i jetri (za održavanje unutrašnje koncentracije NH 3). Uglavnom glnje transportni oblik netoksičnog NH 3 iz mozga, mišića i drugih tkiva. Glutamin lako prodire kroz membranu, jer pri fiziološkom pH, nema naboja. Tokom vežbanja, alanin aktivno prenosi NH3 iz mišića u jetru. Osim toga, velika količina alanina sadrži krv koja curi iz crijeva. Taj alanin se takođe šalje u jetru radi glukoneogeneze.
3 ) Gln i ASN s protokom krvi ulaze u bubrege, gdje se podvrgavaju hidrolizi koristeći posebne enzime - glutaminazu i asparaginazu, a nalaze se i u jetri:
Asn + H 2 OAsp + NH 3.
Gln + H20 OGGlu + NH3.
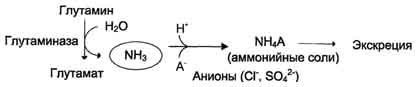
Oslobođeno u tubulima bubrega NH3 neutralizira se stvaranje amonijumskih soli,koji se izlučuju mokraćom:
NH 3 + H + + Cl - NH 4 Cl.
4 )Sinteza uree- Ovo je glavni način neutralizacije amonijaka. Urea čini 80% izlučenog azota.
Proces stvaranja uree događa se u jetri i ciklički je proces nazvan „ ornitinski ciklus "(Krebs - Hanselight ciklus).
U ciklusu sudjeluju dvije aminokiseline koje nisu dio proteina, ornitin i citrulin te dvije proteinogene aminokiseline, arginin i asparagin.
Proces uključuje pet reakcija: prve dvije se odvijaju u mitohondrijama, a ostale u citosolu hepatocita. Neki enzimi koji formiraju urea nalaze se u mozgu, crvenim krvnim ćelijama i srčanom mišiću, međutim, čitav niz enzima nalazi se samo u jetri.
І reakcijaJe li sinteza karbamoil fosfata:
SO 2 + NH 3 + 2ATPNH 2 –CO - F + 2ADP + F n.
Enzim - karbamoil fosfat sintazaІ (mitohondrijalni). Tu je i karbamoilfosfat sintaza II (u citosolu), koja je uključena u sintezu nukleotida pirimidina.
Karbamoilfosfat sintaza I je regulatorni enzim za koji aktivator je N–Acetilglutamat.
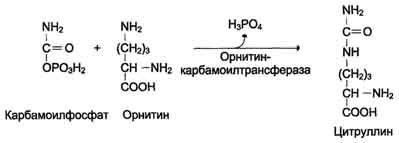
ІІ reakcija- uključivanje karbamoil fosfata u ciklički proces. U ovoj se reakciji kondenzira s ornitinom), što rezultira stvaranjem citrulina (reakcija se javlja i u mitohondrijama).
III reakcija- stvaranje arginin sukcinata. Ovo je druga reakcija koja koristi ATP energiju.
IV reakcija- cijepanje arginina sukcinata s stvaranjem arginina i fumarata. Potonji može ući u Centralnu kontrolnu komisiju poboljšavajući svoj rad. T.O. Ovo je anaplerotska (nadopunjujuća) reakcija za CLK.
V reakcija -regeneracija ornitina sa formiranje uree.
Shema sinteze uree
CO 2 + NH3 + 2ATPkarbamoilfosfat + 2ADP + F n
NH 2 –CO - NH 2
 (urea)Ornitin
(urea)Ornitin
5 2
ArgininCitrulin
4 3 ATP
Fumarate AMF
ArginosukcinatFf n
Enzimi:
1 - karbamoil fosfat sintaza;
2 - ornitinkarbamoiltransferaza;
3 - argininosukcinat sintaza;
4 - argininosukcinatna liza;
5 - arginaza(jaki inhibitori enzima su ornitin i lizin koji se nadmeću s argininom, aktivatorima - Ca 2+ i Mn 2+).
Ornitin, koji se obnavlja tokom ciklusa, može pokrenuti novi ciklus uree. Ornitin je po svojoj ulozi sličan oksaloacetatu u CLK. Za završetak jednog ciklusa potrebna su 3 ATP-a koja se koriste u 1. i 3. reakciji.
Ciklus ornitina usko je povezan sa CLK-om.
Shematski, odnos se može predstaviti na sledeći način:
Ornith-CO 2
novi TsLK
ciklus
Fumarate ATP
Aspartat
Ovo je Krebsov „bicikl na dva kotača“ - niti jedan točak se ne može „okretati“ bez pravilnog funkcionisanja drugog.
Izlučivanje sintetizovane ureje osiguravaju bubrezi. Oslobodi se 20-35 g uree dnevno. Prilikom promjene količine proteina u hrani kako bi se održala ravnoteža dušika, brzina sinteze uree u tijelu se mijenja:
protein sa hranom sinteza enzima iz ciklusa of sinteza uree,
ako je katabolizam proteina sinteza uree i količina
izlazni azot.
Povećani katabolizam proteina i, posljedično, pojačano izlučivanje uree uočeni su za vrijeme posta i dijabetes melitusa.
Kod bolesti jetre, koje su popraćene poremećajem sinteze uree, povećava se koncentracija amonijaka u krvi (hiperammonemija) i, kao rezultat toga, razvija se hepatička koma.
Amonijak nastaje kao posledica deaminacije aminokiselina, amida, amina, kao i nukleotida. Glavni izvor amonijaka je oksidacija glutamata glutamata dehidrogenaza koja nastaje u gotovo svim tjelesnim tkivima.
Budući da je amonijak vrlo toksična supstanca, posebno za nervni sistem, u procesu evolucije razvili su se mehanizmi njegove neutralizacije u ljudskom tijelu. Nivo amonijaka u krvi normalno ne prelazi 50 µmol / L. Toksičnost amonijaka je posledica nekoliko faktora. U tkivima i tjelesnim tekućinama pretežno je amonijak u obliku amonijevog kationa (NH 4 +) koji slabo prodire kroz membrane. No oko 1% slobodnog amonijaka je u ravnoteži s NH4 +, lako prolazi kroz membrane. U mitohondrijama amonijak reagira s alfa-ketoglutaratom u reakciji obrnutog glutamata dehidrogenaze, čime nastaje glutamat. Visok sadržaj amonijaka potiče odliv alfa-ketoglutarata iz ciklusa limunske kiseline i posljedično, smanjenje oksidacije mitohondrije i ATP sinteze, a najosjetljivije stanice mozga dobivaju se energijom gotovo u potpunosti zbog aerobnog razgradnje glukoze.
Glavni krajnji proizvodi metabolizma amonijaka u životinja i ljudi su urea čija nastajanje se događa u jetri. Amonijak se iz perifernih tkiva prenosi u jetru i bubrege u obliku glutamina. Ova aminokiselina nastaje iz glutaminske kiseline dodatkom amonijaka pod djelovanjem glutamin sintetaze.
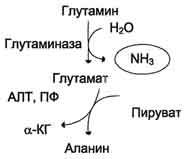
Glutamin je neutralan, netoksičan spoj koji, za razliku od glutamata, lako prolazi kroz stanične membrane. U mozgu se djelovanje glutamin sintetaze kombinira s djelovanjem glutamat dehidrogenaze koja djeluje prvenstveno u smjeru sinteze glutamata s alfa-ketoglutaratom. Iz mozga se glutamin slobodno difundira u krv ili cerebrospinalnu tečnost, a istovremeno eliminira dva molekula toksičnog amonijaka.
Glutamin sintetaza je aktivna i u jetri. Ovdje se održava unutarćelijska koncentracija amonijaka na razini koja ne doseže granice toksičnosti. U jetri i bubrezima glutaminaza hidrolizira glutaminazu do glutamata i slobodnog amonijaka. Neutralna aminokiselina, alanin, uključena je u transport amonijaka iz mišića do jetre. Tokom intenzivnog mišićnog rada, dio aminokiselina se glukoneogenezom pretvara u glukozu. U tim uvjetima se u mišićima formira značajna količina amonijaka. Amonijak stupa u interakciju sa alfa-ketoglutaratom, stvara se glutamat. Potonji interaktivno djeluje s piruvatom, čiji se sadržaj povećava zbog povećane glikolize tijekom rada. Reakcija transaminacije nastaje između piruvata i glutamata.
Alanin se s krvlju prenosi u jetru gdje, pod djelovanjem alanin aminotransferaze, prenosi amino skupinu alfa-ketoglutarata, a zatim se amonijak oslobađa iz glutamata u reakciji glutamata dehidrogenaze. Sa piruvatom u jetri resintezira se glukoza koja se ponovo koristi u mišićima.
Proces cikličke sinteze uree su otkrili G. Krebs i K. Henselight 1932. godine. U ciklusu sudjeluju dvije aminokiseline koje nisu dio proteina (ornitin i citrulin) i dvije aminokiseline sadržane u proteinima (arginin i aspartat). Krebs i Henselight otkrili su da se brzina sinteze uree dramatično povećava kada se medijumu dodaju ornitin, arginin ili citrulin. Na osnovu tih činjenica, Krebs je predložio shemu sinteze uree. Ciklus se sastoji od 5 reakcija od kojih se svaka katalizira posebnim enzimom.
Ciklus uree i ciklus limunske kiseline su usko povezani. Na taj način, opskrba CO2 i ATP-a, potrebnih za stvaranje uree, osigurava se radom ciklusa limunske kiseline. Fumarna kiselina, koja nastaje cijepanjem argininosukcinata, uz sudjelovanje enzima ciklusa limunske kiseline, pretvara se iz malata u oksaloacetat, a potonji ponovo daje aspartat u reakciji transaminacije s glutamatom. Direktni izvori atoma dušika u molekuli uree su amonijak i aspartat. Obe se mogu dobiti iz glutamata: amonijak - oksidativnim deaminacijom, aspartat - transaminacija. I zahvaljujući transaminaciji alfa-ketoglutaratom, sve aminokiseline su u stanju da amino-grupama daju ureu, konačni produkt katabolizma aminokiselina u ljudskom telu.
V. RAZMJENA AMONIJE
A. IZVORI AMONIJE U ĆELICAMA
Katabolizam aminokiselina u tkivima događa se konstantno brzinom od 100 g / dan. U tom slučaju se kao rezultat deaminacije aminokiselina oslobađa velika količina amonijaka.
Šema A
Šema B
Šema B
Značajno manje njegove količine nastaju tijekom deaminacije biogenih amina i nukleotida. Glavni izvori amonijaka u ćelijama prikazani su u tabeli. 9-3.
Deo amonijaka nastaje u crevima.kao rezultat djelovanja bakterija na prehrambene proteine \u200b\u200b( propadanje proteina ucrijeva) i ulazi u krv sa portalnom venom. Koncentracija amonijaka u krvi portalne vene znatno je veća nego u općem krvotoku. U jetri se zadržava velika količina amonijaka što održava nizak sadržaj toga u krvi. Koncentracija amonijaka u krvi normalno rijetko prelazi 0,4-0,7 mg / l (ili 25-40 mikromol / l). Pri fiziološkim pH vrijednostma, amonijak u krvi i citosolu stanica prelazi u amonijum ion - NH4 +, količina neionizirane NH3 je mala (~ 1%).
Amonijak je toksično jedinjenje. Čak i lagano povećanje njegove koncentracije štetno djeluje na organizam, a posebno na centralni nervni sistem. Dakle, porast koncentracije amonijaka u mozgu do 0,6 mmol uzrokuje napadaje. Simptomi hiperammonemije uključuju tremor, mutni govor, mučninu, povraćanje, vrtoglavicu, napadaje i gubitak svijesti. U težim slučajevima razvija se koma sa smrtnim ishodom.
Mehanizam toksičnog dejstva amonijakana mozak i na tijelo kao cjelinu očito je povezana s njegovim djelovanjem na nekoliko funkcionalnih sistema.
- Amonijak lako prodire kroz membrane u ćelije i, u mitohondrijama, prebacuje reakciju kataliziranu glutamat dehidrogenazom prema stvaranju glugama:
α-ketoglutarat + NADH + H + + NH3 → glutamat + NAD +.
Smanjenje koncentracije α-ketoglutarata uzrokuje:
- ugnjetavanjarazmjenu aminokiselina (transminatorske reakcije) i, shodno tome, sintezu neurotransmitera (acetilholina, dopamina itd.) iz njih;
- hipoenergetsko stanje ukao rezultat smanjenja brzine CTK.
Tabela 9-3. Glavni izvori amonijaka
| Izvor | Proces | Enzimi | Lokalizacija procesa |
| Aminokiseline | Neizravno deaminiranje (glavni put za deaminaciju aminokiselina) | Aminotransferaze, PF glutamat dehidrogenaza, NAD + | Sve tkanine |
| Glutamat oksidativno deaminacija | Glutamat dehidrogenaza, NAD + | Sve tkanine | |
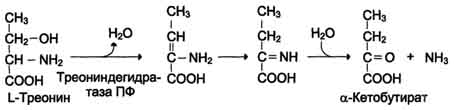
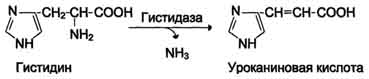
| Neoksidirajuće deaminacija Gis, Ser, Tre | Histidaza-serin, treonin dehidratataza, PF | Uglavnom jetra | |
| Oksidativna deaminacija aminokiselina (beznačajan način deaminacije) | L-aminokiselinska oksidaza, FMN | Jetra i bubrezi | |
| Biogeni amini | Oksidativna deaminacija (put inaktivacije biogenih amina) | Amino oksidaze, FAD | Sve tkanine |
| AMF | Hidrolitička deaminacija | AMP deaminaza | Intenzivno djeluje mišić |
Nedovoljnost α-ketoglutarata dovodi do smanjenja koncentracije metabolita CTK, što uzrokuje ubrzanje sinteze oksaloacetata iz piruvata, praćeno intenzivnom potrošnjom CO 2. Povećana formacija i potrošnja ugljičnog dioksida tokom hiperammonemije posebno je karakteristična za moždane stanice.
- Povećanje koncentracije amonijaka u krvi prebacuje pH na alkalnu stranu (uzrokuje) alkaloza) To, sa svoje strane, povećava afinitet hemoglobina prema kisiku, što dovodi do hipoksije tkiva, nakupljanja CO 2 i hipoenergetskog stanja, od kojeg mozak uglavnom pati.
- Visoke koncentracije amonijaka stimulišu sintezu glutaminaiz glutamata u nervnom tkivu (sa učešćem glutamin sintetaze):
Glutamat + NH 3 + ATP → Glutamin + ADP + H 3 P0 4.
- Akumulacija glutamina u stanicama neuroglije dovodi do povećanja osmotskog tlaka u njima, oticanja astrocita i u visokim koncentracijama može uzrokovati edem mozga. Redukcija glutamatanarušava metabolizam aminokiselina, posebno neurotransmitera sinteza y-aminobuterne kiseline(GABA), glavni posrednik kočenja. Uz nedostatak GABA i drugih medijatora, provođenje nervnog impulsa je poremećeno, javljaju se konvulzije.
- Jon NH 4 + praktično ne prodire u citoplazmatske i mitohondrijske membrane. Višak amonijevog iona u krvi sposoban je da poremeti transmembranski prijenos monovalentnih Na + i K + kationa, natječući se s njima za ionske kanale, što također utječe na provođenje živčanih impulsa.
B. Vezivanje (neutralizacija) amonijaka
Veliki intenzitet procesa deaminacije aminokiselina u tkivima i vrlo nizak nivo amonijaka u krvi ukazuju na to da se amonijak aktivno vezuje u ćelijama uz stvaranje netoksičnih spojeva koji se izlučuju iz tijela urinom. Te se reakcije mogu smatrati reakcijama neutralizacije amonijaka. Nekoliko vrsta takvih reakcija pronađeno je u različitim tkivima i organima.
Glavna reakcija vezivanja amonijaka koja se javlja u svim tjelesnim tkivima je
sinteza glutamina glutamin sintetazom:
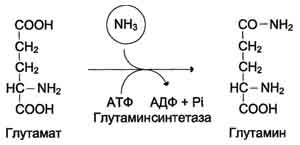
Glutamin sintetaza lokalizirana je u mitohondrijama ćelija, da bi enzim djelovao, potreban je kofaktor, joni Mg 2+. Glutamin sintetaza jedan je od glavnih regulatornih enzima za metabolizam aminokiselina i alosterično ga inhibira AMP, glukoza-6-fosfat, kao i Gly, Ala i His.
Glutamin se lako transportira kroz stanične membrane olakšavanjem difuzije (moguć je samo aktivni transport glutamata) i ulazi u krv iz tkiva. Glavno opskrbljujuće tkivo: i glutamin su mišići, mozak i jetra. Sa protokom krvi, glutamin se transportira u creva i bubrege.
U crevnim ćelijamapod djelovanjem enzima glutaminaze dolazi do hidroliznog oslobađanja amidnog azota u obliku amonijaka:
Glutamat nastao u reakciji podvrgava se transaminaciji s piruvatom. Os-amino grupa glutaminske kiseline prenosi se u sastav alanina (Sl. 9-10). Velike količine alanina ulaze u portalnu venu iz creva i apsorbuje jetra. Oko 5% formiranog amonijaka se odstrani kao dio izmeta, mali dio prolazi portalnom venom u jetru, preostalih ~ 90% izlučuje bubrezima.
U bubrezimanastaje i hidroliza glutamina pod djelovanjem glutaminaze uz stvaranje amonijaka. Ovaj postupak je jedan od mehanizama regulacije acidobazne ravnoteže u tijelu i očuvanja najvažnijih kationa za održavanje osmotskog tlaka. Bubrežna glutaminaza se značajno inducira u acidozi, rezultirajući amonijak neutralizira kisele produkte metabolizma i izlučuje se u obliku amonijevih soli u urinu (Sl. 9-11). Ova reakcija štiti tijelo od pretjeranog gubitka Na + i K + jona koji se također mogu koristiti za uklanjanje aniona i biti izgubljen. S alkalozom se smanjuje količina glutaminaze u bubrezima.
Oko 0,5 g amonijum soli dnevno se formira i izlučuje u bubrezima.
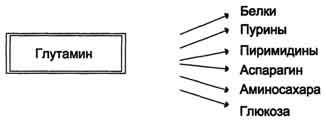
Visoki nivoi glutamina u krvi i lakoća njegovog ulaska u ćelije određuju upotrebu glutamina u mnogim anaboličkim procesima. Glutamin je glavni donator dušika u tijelu.Azot glutamin amida koristi se za sintezu purina i pirimidina.
Sl. 9-11. Metabolizam azota glutamin amida u bubrezima.
nukleotide, asparagin, amino šećere i druge spojeve (Sl. 9-12).
Može se razmotriti i druga reakcija neutralizacije amonijaka u tkivima sinteza asparaginapod uticajem asparagin sintetaze.
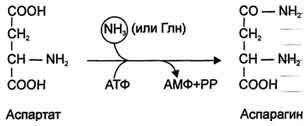
Postoje 2 izoforme ovog enzima - glutaminski zavisni i od amonijaka, koji koriste različite donore amidnih grupa. Prethodne funkcije u životinjskim ćelijama, druge prevladavaju u bakterijskim ćelijama, ali je prisutna i u životinjama. Međutim, ovaj način neutralizacije amonijaka u ljudskim ćelijama se rijetko koristi i zahtijeva i više energije (energije dviju makroergičnih veza) nego sinteza glutamina.
Najznačajnije količine amonijaka neutraliziraju se u jetri sinteza uree.U prvoj reakciji postupka amonijak se veže na ugljični dioksid i stvara karbamoil fosfat, te se troše 2 molekula ATP-a. Reakcija se odvija u mitohondrijama hepatocita pod djelovanjem enzima karbamoilfosfat sintetaza I. Karbamoilfosfat sintetaza II lokalizirana je u citosolu stanica svih tkiva i uključena je u sintezu nukleotida gsrimidina (vidjeti dio 10). Karbamoil fosfat se zatim uključuje u ornitinski ciklus i koristi se za sintezu uree.
U mozgu i nekim drugim organima može procuriti. reduktivna aminacija α -ketoglutaratpod djelovanjem glutamat dehidrogenaze što katalizira reverzibilnu reakciju. Međutim, ovaj način neutralizacije amonijaka u tkivima slabo se koristi, jer glutamat dehidrogenaza katalizira uglavnom deaminaciju glutamata. Iako je, uzimajući u obzir naknadno stvaranje glutamina, reakcija korisna za stanice, jer potiče vezanje 2 molekula NH3 odjednom.
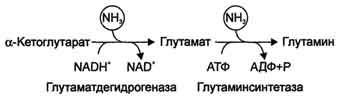
Iz mišića i creva, višak amonijaka se izlučuje uglavnom u obliku alanina. Ovaj mehanizam je neophodan, s obzirom da je aktivnost glutamata dehidrogenaze u mišićima mala, a indirektno deaminiranje aminokiselina je neefikasno. Zbog toga u mišićima postoji drugi način izlučivanja azota. Stvaranje alanina u tim organima može se predstaviti sledećom shemom (vidi donju shemu).
Amino grupe različitih aminokiselina prenose se transaminacijom u piruvat, čiji je glavni izvor proces oksidacije glukoze.
Mišići izlučuju puno alanina zbog velike mase i aktivne potrošnje.
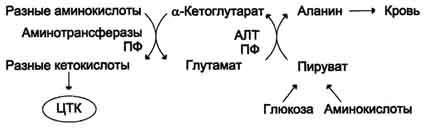
Šema
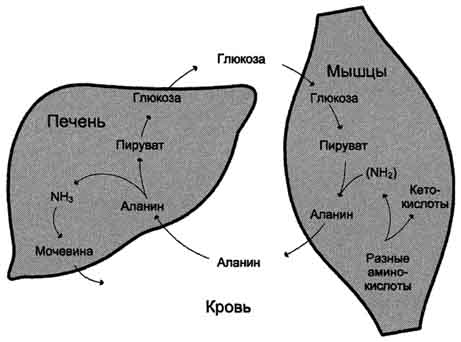
glukoze tokom fizičkog rada, a takođe i zbog toga što dio energije dobivaju uslijed razgradnje aminokiselina. Nastali alanin ulazi u jetru, gde se podvrgava indirektnom odvajanju. Oslobođeni amonijak se neutralizira, a piruvat je uključen u glukoneogenezu. Glukoza iz jetre ulazi u tkiva i tamo se, u procesu glikolize, ponovo oksidira u piruvat (Sl. 9-13).
Stvaranje alanina u mišićima, njegov transfer do jetre i prijenos glukoze sintetizirane u jetri nazad u mišiće ciklus glukoze-alanina,čiji se rad povezuje s radom ciklusa glukoza-laktat (vidjeti dio 7).
Skup osnovnih procesa metabolizma amonijaka u tijelu prikazan je na Sl. 9-14. Glutamat dehidrogenaza i glutamin sintetaza su dominantni enzimi u razmjeni amonijaka.
B. ciklus ornitina
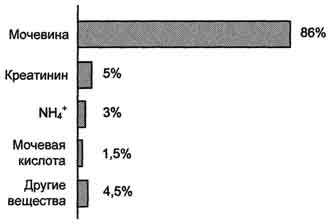
Urea je glavni krajnji produkt metabolizma dušika,u čijem se sastavu iz organizma oslobađa do 90% sveg dušika izlučenog (sl. 9-15). Izlučivanje uree normalno je ∼25 g / dan.
S porastom količine proteina koji se konzumira s hranom povećava se izlučivanje uree. Urea se sintetiše samo u jetri, što je utvrđeno u eksperimentima I.D. Pavlova. Oštećenja jetre i kršenje sinteze uree dovode do povećanja sadržaja amonijaka i aminokiselina (prvenstveno glutamina i alanina) u krvi i tkivima.
U 40-im godinama XX vijeka njemački biohemičari G. Krebs i K. Henseleit utvrdili su da je sinteza uree ciklički proces koji se sastoji od više stupnjeva, a čiji je ključni spoj, zatvarajući ciklus, ornitin. Stoga se zove postupak sinteze uree "ornitinski ciklus"ili „Krebs-Hanseleitov ciklus“.
1. Reakcije sinteze uree
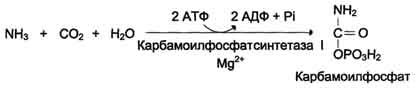
Urea (urea) - kompletan amid ugljene kiseline - sadrži 2 atoma dušika. Izvor
jedanod kojih je amonijakkoji se u jetri veže na ugljični dioksid
Sl. 9-14. Razmjena amonijaka. Glavni izvor amonijaka su aminokiseline. Većina nastalog amonijaka neutralizira se u ornitinskom ciklusu u jetri i izlučuje kao urea. Glavna reakcija neutraliziranja amonijaka u tkivima je sinteza glutamina, koji se potom koristi u anaboličkim procesima i za neutralizaciju tvari u jetri. Enzimi glutamat dehidrogenaza i glutamin sintetaza su regulatorni i određuju brzinu stvaranja i neutralizacije amonijaka.
karbamoil fosfat pod djelovanjem karbamoil fosfat sintetaze I (vidjeti shemu A dolje).
U sljedećoj reakciji argininosukcinatna sintetaza veže citrulin sa aspartatom i stvara argininosukcinat (argininosukcininska kiselina). Ovaj enzim treba Mg 2+ iona. U reakciji se troši 1 mol ATP-a, ali koristi se energija dviju makroergičnih veza. Aspartat - izvor drugog atoma dušika uree(vidi shemu A na stranici 483).
Šema A
Šema B
Arginin se podvrgava hidrolizi pod djelovanjem arginaze, uz stvaranje ornitina i uree. Kofaktori arginaze su Ca 2+ ili Mn 2+ ioni. Visoke koncentracije ornitina i lizina, koji su strukturni analozi arginina, inhibiraju aktivnost ovog enzima:
Nastali ornitin stupa u interakciju s novom molekulom karbamoil fosfata i ciklus se zatvara.
Prve dvije reakcije procesa nastaju u mitohondrijama hepatocita. Zatim se citrulin, koji je proizvod tih reakcija, prevozi do citosola, gdje se provode daljnje transformacije (sl. 9-16).
Ukupna jednadžba za sintezu uree:
SO 2 + NH 3 + Aspartat + 3 ATP + 2 N 2 O → Urea + Fumarat + 2 (ADP + N 3 R0 4) + AMP + H 4 P 2 O 7.
Amonijak koji koristi karbamoilfosfat sintetaza I dovodi u jetru krvlju iz portalne vene. Uloga drugih izvora, uključujući brzo deaminacija glutamin eta u jetri je znatno manja.
Aspartat, neophodan za sintezu argininocinata, nastaje u jetri transaminacijom.
Šema B
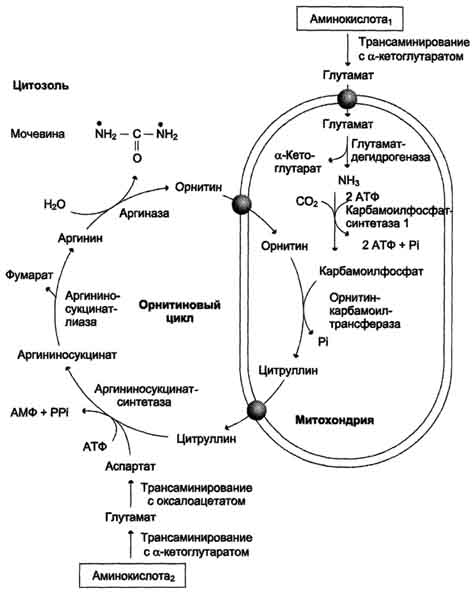
Sl. 9-16. Krebs-Hanseleit ornitinski ciklus. Oksidativna deaminacija glutamata događa se u mitohondrijama. Enzimi ornitinskog ciklusa raspoređeni su između mitohondrija i citosola. Stoga je potreban transmembranski prijenos glutamata, citrulina i ornitina uz pomoć specifičnih translokaza. Dijagram prikazuje puteve za ugradnju azota dvije različite aminokiseline (aminokiselina 1 i aminokiselina 2) u molekulu uree: • jedna amino grupa - u obliku amonijaka u mitohondrijalnom matriksu; • Druga amino grupa dobiva se citosol aspartatom.
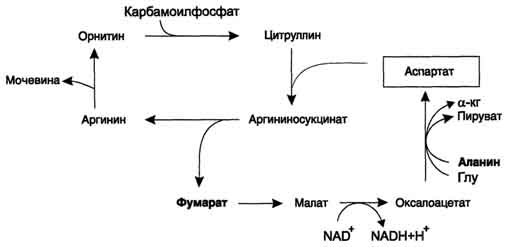
alanin s oksaloacetatom. Alanya uglavnom dolazi iz mišića i ćelija creva. Izvor oksaloacetata potreban za ovu reakciju može se smatrati konverzijom fumarata koji nastaje u reakcijama ornitinskog ciklusa. Kao rezultat dvije reakcije citratnog ciklusa, fumarat se pretvara u oksaloacetat, iz kojeg se transaminacijom formira aspartat (sl. 9-17). Tako se s ciklusom ornita uparava ciklus regeneracije aspartata iz fumarata.Piruvat, nastao iz alanina u ovom ciklusu, koristi se za glukoneogenezu.
Drugi izvor aspartata za ornitinski ciklus je transaminacija glutamata oksaloacetatom.
2. Energetska ravnoteža procesa
Četiri makroergične veze od tri molekule troše se u reakcijama ornitinskog ciklusa
ATP za svaku obrtaju ciklusa. Međutim, proces pretvaranja aminokiselina u ostatke i urea bez azota ima načina da se nadoknade troškovi energije:
- kada je fumarat uključen u CCC, u fazi dehidriranja malata nastaje NADH, što osigurava sintezu 3 ATP molekule (sl. 9-18);
- tokom oksidativnog deaminiranja glutamata u različitim organima nastaje i NADH, odnosno još 3 ATP molekule.
Troškovi energijenastaju i za vrijeme transmembranskog transporta tvari povezanih sa sintezom i izlučivanjem uree (Sl. 9-18). Prve dvije reakcije ornitinskog ciklusa javljaju se u mitohondrijama, a sljedeće tri u citosolu. Citrulin formiran u mitohondrijama mora se prenijeti u citosol, a ornitin koji nastaje u citosolu mora se prevesti u mitohondrije. Uz to, u bubrezima, prijenos uree iz krvi u urin događa se aktivnim transportom zbog gradijenta natrijevih jona stvorenih K +, Na + -ATPazom, koji je također povezan s potrošnjom energije.
Kompletan set enzima iz ornitinskog ciklusa nalazi se samo u hepatocitima. Odvojeni enzimi ornitinskog ciklusa nalaze se ne samo u jetri, već i u drugim ćelijama. Enterociti, na primjer, imaju karbamoilfosfat sintetazu I i ornitinkarbamoil transferazu, pa se citrulin može sintetizovati. Argininosukcinatna sintetaza i argininosukcinatna liza pronađeni su u bubrezima. Citrulin formiran u enterocitima može ući u bubrege i tamo se pretvoriti u arginin koji se transportira u jetru i hidrolizira arginazom. Aktivnost ovih enzima raspršenih u različitim organima mnogo je manja nego u jetri.
3. Biološka uloga ornitinskog ciklusa
Krebs-Hanseleit
Ciklus ornitina u jetri obavlja 2 funkcije:
- pretvorba dušika aminokiselina u ureu koja se izlučuje i sprječava nakupljanje toksičnih proizvoda, uglavnom amonijaka;
- sinteza arginina i nadopunjavanje njegovog fonda u tijelu.
Regulatorne faze postupka su sinteza karbamoil fosfata, sinteza citrulina i završni stadij, katalizirane arginazom. Učinkovitost ciklusa ornitina uz normalnu ljudsku prehranu i umjerene fizičke napore otprilike je 60% njegove snage. Rezerva energije je potrebna da bi se izbjegla hiperammonemija sa promjenama količine proteina u hrani. Povećanje brzine sinteze uree događa se kod dugotrajnog fizičkog rada ili dugotrajnog gladovanja, što je praćeno raspadom proteina u tkivu. Neka patološka stanja karakterizirana intenzivnim razgradnjom proteina
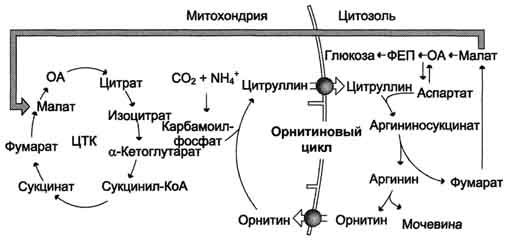
Sl. 9-18. Odnos orninskog ciklusa i općeg puta katabolizma. Fumarat nastao cijepanjem argininosukcinata pretvara se u malat koji se zatim prebacuje u mitohondrije, ugrađuje se u TCA i dehidrira kako bi se stvorio oksaloacetat. Ovu reakciju prati oslobađanje 3 ATP molekula, koji nadoknađuju potrošnju energije za sintezu jedne molekule uree.
tkiva (šećerna bolest itd.) također je praćena aktivacijom ornitinskog ciklusa. Uz prekomjernu prehranu bjelančevinama, povećava se broj enzima iz ornitinskog ciklusa u jetri, što dovodi do intenziviranja sinteze uree.
4. Hiperamonijemija
Kršenje reakcija neutralizacije amonijaka može uzrokovati povećan amonijak u krvi- hiperammonemija, koja ima toksični efekat na organizam. Uzroci hiperammonemije mogu biti genetska oštećenja enzima iz ornitinog ciklusa u jetri i sekundarno oštećenje jetre kao posljedica ciroze, hepatitisa i drugih bolesti. Poznato je pet nasljednih bolesti koje su prouzrokovane defektom u pet enzima ornitinskog ciklusa (Tabela 9-4).
U literaturi su opisani slučajevi svih ovih prilično rijetkih enzima, među kojima je zapažen najveći broj slučajeva hiperammonemije tipa II.
Kršenje ciklusa ornitina opaženo je kod hepatitisa različite etiologije i nekih drugih virusnih bolesti. Na primjer, otkriveno je da virusi gripa i druge akutne respiratorne virusne infekcije smanjuju aktivnost karbamoilfosfat sintetaze I. Hiperamonijemija se takođe često opaža kod ciroze i drugih bolesti jetre.
Smanjenje aktivnosti bilo kojeg enzima za sintezu uree dovodi do nakupljanja u krvi supstrata ovog enzima i njegovih prethodnika. Dakle, s defektom u argininosukcinatnoj sintetazi povećava se sadržaj citrulina (citrulininemija); sa defektom arginaze - koncentracija arginina, argininosukcinata, citrulina i sl. Hiperammonemija tipa I i II, karbamoil fosfat akumulira se u mitohondrijama i izlazi u citosol zbog oštećenja ornitinske karbamoiltransferaze. To uzrokuje porast brzine sinteze nukleotida pirimidina (uslijed aktivacije karbamoilfosfat sintetaze II), što dovodi do nakupljanja orotata, uridina i uracila i njihovog izlučivanja u urinu. Sadržaj svih metabolita povećava se, a stanje pacijenata pogoršava se s povećanjem količine proteina u hrani. Ozbiljnost tijeka bolesti ovisi i o stupnju smanjenja aktivnosti enzima.
Svi poremećaji ornitinskog ciklusa dovode do značajnog povećanja koncentracije amonijaka, glutamina i alanina u krvi.
Hiperamonijemijapraćeno pojavom sledećih simptoma:
- mučnina, opetovano povraćanje;
- vrtoglavica, konvulzije;
- gubitak svijesti, cerebralni edem (u teškim slučajevima);
- mentalna zaostalost (u hroničnom kongenitalnom obliku).
Tabela 9-4. Nasljedni poremećaji ornitinskog ciklusa i njihove glavne manifestacije
| Bolest | Defekt enzim |
Tip nasledstva | Klinički manifestacije |
Metaboliti | |
| krv | urin | ||||
| Hyperam- moniemia tip I |
Karbamoil fosfat sintetaza I |
Autosomno recesivni |
U roku od 24-48 sati nakon rođenja kome, smrt | Gln Ala NH 3 |
Orotat |
| Hyperam- moniemia tip II |
Ornitin karbamoil transferaza |
X-povezano | Hipotenzija, smanjena tolerancija na proteine | Gln Ala NH 3 |
Orotat |
| Citrul linemija |
Arginin sukcinat sintetaza |
Autosomno recesivni |
Hiperammonemija je teška kod novorođenčadi. Kod odraslih - nakon punjenja proteinima | Citrulin NH 3 |
Citrulin |
| Arginin sukcin turija |
Arginin sukcinat liza |
Autosomno recesivno | Hiperamonije, ataksija, konvulzije, gubitak kose | Argini nesnosan NH 3 |
Argini nosucci nat, Gln, Ala, Liz |
| Hyperrar gininemija |
Arginase | Autosomno recesivno | Hyperargininemia | Apr NH 3 |
Apr Liz Ornitin |
Svi simptomi hiperammonemije su manifestacija djelovanja amonijaka na centralni nervni sistem (vidjeti pododjeljak IV, B gore).
Za dijagnozu različitih vrsta hiperammonemije utvrđuje se sadržaj amonijaka u krvi, metaboliti ornitinog ciklusa u krvi i urinu, aktivnost enzima u biopsiji jetre.
Glavni dijagnostički simptom jepovećana koncentracija amonijaka u krvi. Sadržaj amonijaka u krvi može dostići 6000 μmol / L (normalno - 60 μmol / L). Međutim, u većini hroničnih slučajeva nivo amonijaka može porasti tek nakon punjenja proteinima ili tokom akutnih kompliciranih bolesti.
Lečenjepacijenti s različitim defektima orninskog ciklusa uglavnom su usmjereni na smanjenje koncentracije amonijaka u krvi zbog dijeta sa malo proteina, unošenje keto analoga aminokiselina u prehranu i poticanje uklanjanja amonijaka zaobilazeći poremećene reakcije:
- vezivanjem i eliminacijom NH3 u sastavu fenilacetilglutamina i histurinske kiseline;
- porast koncentracije intermedijarnih metabolita ciklusa (arginin, citrulin, glutamat) koji nastaju izvan blokiranih reakcija (Sl. 9-19).
Fenilacetat, koji se daje pacijentu s nedostatkom karbamoilfosfat sintetaze I kao dodatak prehrani, stvara fenilacetilglutamin koji se izlučuje bubrezima kao rezultat njegove konjugacije s glutaminom. Istovremeno se poboljšava stanje pacijenata jer se aktivira sinteza glutamina i smanjuje se koncentracija amonijaka u krvi (sl. 9-19, A).
Sličan učinak ima i uvođenje benzoata, koji veže molekul glicina. Nastala kiselina izlučuje se mokraćom (Sl. 9-19, B). Kao dio hippurata, dušik se oslobađa iz tijela. Nedostatak glicina nadoknađuje se ili njegovom sintezom iz serina, ili nastajanjem NH3 i CO2 u reakciji kataliziranoj glicin sintetazom. U ovom slučaju stvaranje glicina prati vezanje jednog molekula amonijaka.
Kod hiperammonemije tipa II (defekt ornitinkarbamoiltransferaze) uvođenje velikih
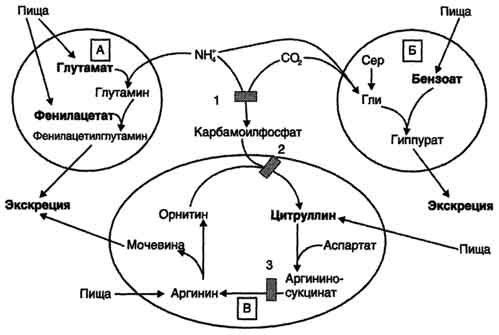
Sl. 9-19. Načini uklanjanja amonijaka kada su u prehranu uključeni glutamat i fenilacetat (A), benzoat (B), citrulin i arginin (C). Na slici su prikazani blokovi enzima: 1 - defekt karbamoilfosfat sintetaze I; 2-defektna ornitinkarbamoiltransferaza; 3 - defekt argininosukcinatnog liza.
doze citrulina potiču sintezu uree iz aspartata (Sl. 9-19, B), što takođe dovodi do apsorpcije azota iz organizma. Uvođenje velikih doza arginina u argininosukcinaturiju (nedostatak argininosukcinatne lize) potiče regeneraciju izlučivanja ornitina i dušika u sastavu citrulina i argininosukcinata.
D. Razmjena amonijaka i aminokiselina između organa i tkiva
Mnoga tkiva su uključena u katabolizam aminokiselina i stvaranje amonijaka. Amonijak se veže u ćelijama. Dušik se iz tijela izlučuje u obliku dva krajnja produkta metabolizma dušika - amonijevih soli (~ 0,5 g / dan), koji se stvaraju u bubrezima, i uree (~ 25 g / dan), koja sadrži do 90% izlučenog dušika. Urea se sintetiše u jetri tokom ciklusa ornitina, a 1 mol amonijaka i 1 mol aspartanske kiseline koriste se za stvaranje 1 mola uree. Tako se za sintezu 25 g uree dnevno potroši 6,3 g amonijaka i 50 g aspartata. Posebni mehanizmi moraju intenzivno funkcionirati kako bi dostavljali dušik u jetru.
Transport dušika iz tkiva u jetrunastaje uglavnom u sastavu 3 spojeva: glutamin, alanin, amonijak (mala količina u nevezanom obliku).
Pored glutamina i alanina, u krvi su prisutne i ostale slobodne aminokiseline, a njihov sadržaj i smjer transporta ovise o unosu hrane i upotrebi endogenih proteina. Najveća količina slobodnih aminokiselina dolazi iz mišića i crijeva, a do 50% je alanin i glutamin. Usmeren je protok aminokiselina iz ovih tkiva do jetre koji se povećava tokom apsorpcijskog unosa proteinskom hranom.
Većina glutamina dostavlja se u krv. mišiće i mozak.Iz krvotoka ga apsorbiraju jetra i bubrezi, gdje je izložena glutaminazi. Bubrega- glavni izvor serina i djelimično alanina koji se iz jetre plazme sortira. Mozakza razliku od svih ostalih tkiva, može apsorbirati i oksidirati velike količine aminokiselina razgranatog lanca (valin, leucin, izoleucin).
Nakon jela odcrijeva u krvnu plazmu primaju puno aminokiselina, i
preovlađuju aminokiseline razgranatog bočnog lanca (do 20% ukupnog broja), koje apsorbiraju uglavnom jetra, mišići i mozak (Sl. 9-20). U mišićima se pojačava katabolizam ovih aminokiselina i one djeluju kao glavni donori amino grupe u sintezi alanina iz piruvata (vidjeti gore „glukozno-alanin ciklus“).
U periodu postabsorpcijeglavni izvori slobodnih aminokiselina su mišići. Opskrbljuju se uglavnom alaninom i glutaminom (slika 9-21). Alanin se apsorbuje jetrom, glutamin - crevima i bubrezima. U crevima se glutaminski azot prenosi u alanin ili seriju i u njihovom sastavu prenosi u jetru gde se aktivira proces glukoneogeneze. Intenzitet glukoneogeneze iz ovih aminokiselina je puno veći nego od svih ostalih. Dakle, alanin i serija su glavne glikogene aminokiseline. Aminokiseline razgranatog lanca (valin, leucin, izoleucin itd.), Koje se oslobađaju iz mišića, šalju se u mozak, gdje se oksidiraju i služe kao važan izvor energije.
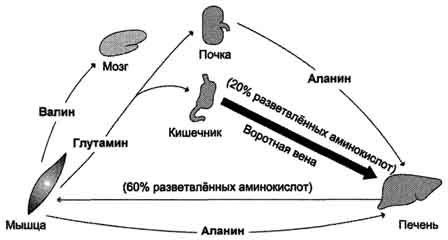
Sl. 9-20. Razmjena aminokiselina između tkiva i organa u apsorpcijskom periodu. U apsorpcijskom razdoblju crijevo je glavni izvor slobodnih aminokiselina. Većina dolazećih aminokiselina su razgranate hidrofobne aminokiseline. Egzogene polarne aminokiseline iz portalne vene sorbiraju se i koriste uglavnom jetra. Razgranate aminokiseline apsorbiraju se iz krvi iz mozga ili mišićnih stanica.
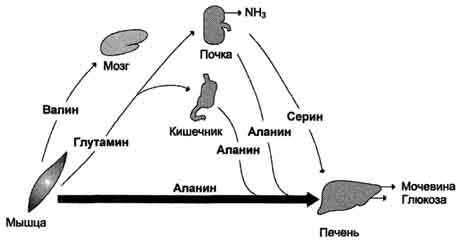
Sl. 9-21. Razmjena aminokiselina između tkiva i organa u periodu postabsorpcije. U periodu postabsorpcije, slobodne aminokiseline dolaze uglavnom iz mišića u kojima je pojačan katabolizam proteina. Aminokiseline se koriste u glukoneogenezi u jetri. Povišene su razine alanina, serina i glutamina u krvi.
