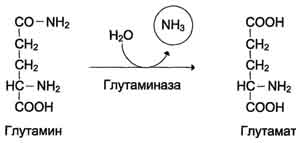
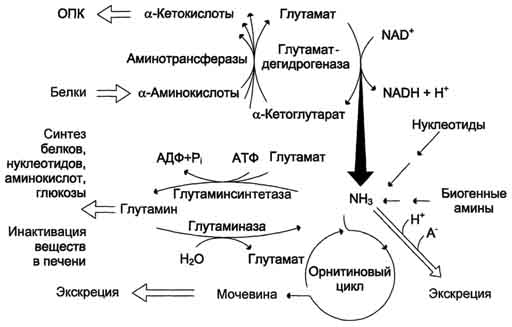
Glavni mehanizem nevtralizacije amoniaka v telesu je biosinteza sečnine. Slednji se izloči z urinom kot glavnim končnim produktom beljakovin, oziroma aminokislin, presnove. Urea predstavlja do 80-85% vsega dušika v urinu. Glavno in morda edino mesto sinteze sečnine so jetra. G. Krebs in K. Hanselyight sta leta 1932 prvič izpeljala enačbe za reakcije sinteze sečnine, ki so predstavljene v obliki cikla, imenovanega v literaturi krebsov cikel sečnine ornitin.
Treba je opozoriti, da je bil to v biokemiji prvi ciklični presnovni sistem, katerega opis je skoraj 5 let določal G. Krebs z odkritjem drugega metaboličnega procesa - cikla trikarboksilne kisline. Nadaljnje študije so v veliki meri potrdile ciklično naravo biosinteze sečnine v jetrih. Zahvaljujoč raziskavam G. Cohen, S. Ratner idr. razjasnjeni so bili vmesni koraki in encimski sistemi, ki katalizirajo nastanek sečnine.
Tako lahko celoten cikel sečnine predstavljamo na naslednji način. Na prvi stopnji se sintetizira makroergična spojina karbamoil fosfat - presnovno aktivna oblika amoniaka, ki se uporablja kot začetni produkt za sintezo pirimidinskih nukleotidov (DNA oziroma RNA) in arginina (beljakovine in sečnine):
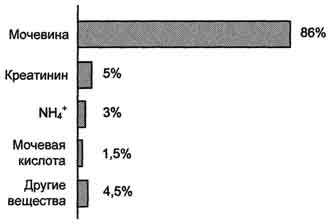
Sečnina je glavni končni produkt presnove dušika, v sestavi katerega se iz telesa izloči presežek dušika.
Cikel ornitina v jetrih opravlja dve funkciji:
Pretvorba aminokislin v sečnino, ki se izloči in preprečuje kopičenje strupenih produktov, predvsem amoniaka;
Sinteza arginina in dopolnitev njegovega sklada v telesu.
Razmislite o ciklu sečnine:
![]()
Slika 34 - Sinteza ornitina sečnine v jetrih
Začne se s tvorbo karbamoil fosfata v mitohondrijah, kjer je veliko ATP.
1 Tvorba karbamoil fosfata. Amonijevi ioni, ki nastanejo pri oksidativnem razkroju glutaminske kisline, medsebojno delujejo z bikarbonatnim anionom in ATP s sodelovanjem karbamoilfosfat sintetaze in tvorijo karbamoilfosfat, ki vsebuje makroergično vez:
NN 4 + + НСО 3 - + 2ATF → N 2 N - С + 2АФФ + Н 2 РО 4 - + Н +
Karbamoil fosfat
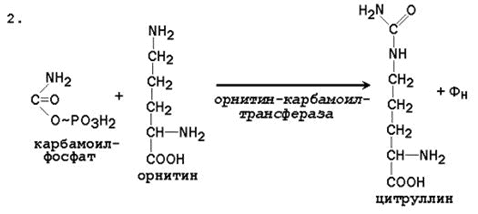
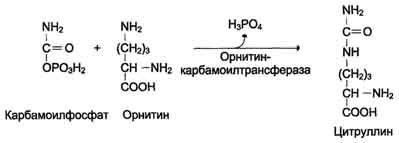
2. Pridobivanje citrulina. V mitohondrijskem matriksu se karbamoil fosfat kondenzira z aminokislino ornitinom, ki kot homolog lizina ni del beljakovin.
Reakcija katalizira ornitkarkarmoamotransferaza:
N СОO - O N SOO -
С + Н 2 N - С → СО + Н 2 РО 4 -
+ / \ + \ + / \ ||
N 3 N (SN 2) 3 NN 3 O ~ F H3N (CH2) 3NH-C-NH2
Ornitin-karbamoil-fosfat citrulin
Tako dobljeni citrulin prehaja v citosol jetrnih celic, kjer se pojavijo preostale reakcije cikla sečnine.
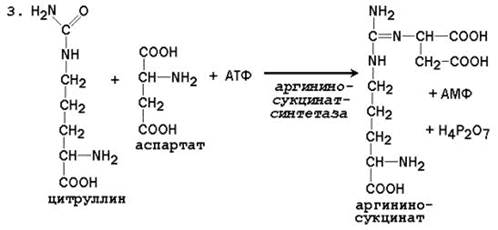
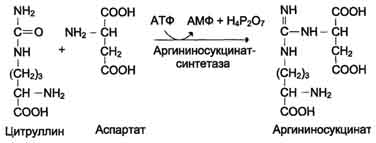
3. Pridobivanje arginin sukcinata. Nadomeščanje karbonilne skupine citrulina z amino skupino aspartata s tvorbo gvanidinske skupine argininosukcinata poteka s sodelovanjem ATP in katalizira argininosukcinat sintetaza:
N SOO - N SOO -
C O + C + ATP →
N 3 N (SN 2) 3 NN - S - NN 2 N 3 N SN 2 SOO -
Citrulinski aspartat
S N 2 N SN 2 SOO - + N 2 R 2 O 7 2- + AMP
N 3 N (SN 2) 3 NN - S - NN - SNSOO -
Arginin sukcinat
Reakcija je energijska; v prvi in \u200b\u200btretji reakciji cikla porabimo 4 ATP molekule.
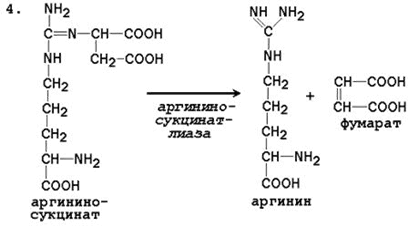
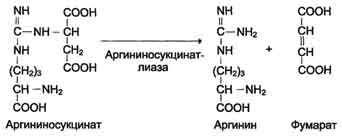
4. Razpad arginina sukcinat. Argininosukcinatna liza se pod delovanjem argininosukcinatne liasa razgradi z nastankom arginina in fumarata:
N SOO - N SOO - SOO - N
S N 2 N SN 2 SOO - → S N 2 N + S \u003d S
+ / \ || | + / \ || / \
N 3 N (SN 2) 3 NN - S - NN - SNSOO - N 3 N (SN 2) 3 NN - S - NH 2 N SOO -
Arginin sukcinat Arginin fumarat
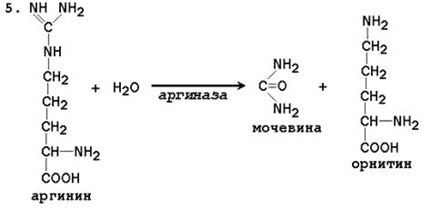
5. Tvorba sečnine in regeneracija ornitina. Hidroliza arginina, katalizirana z arginazo, vodi do nastanka sečnine in regeneracije ornitina. Reakcija je eksergonična.
N COO - N SOO - NN 2
С Н 2 N → С + О \u003d С
+ / \ || + / \ + \
H3N (CH2) 3NH-C -NH2H3N (CH2) 3NH3NH2
Arginin Ornitin sečnina
Regenerirani ornitin lahko spet vstopi v mitohondrije in sodeluje v novem prometu cikla sečnine. Kri prenese sečnino, ki se tvori iz jeter, v ledvice, kjer se izvleče iz krvi in \u200b\u200bse z urinom odstrani iz telesa.
V ornitinskem ciklu porabimo 4 makroergične vezi treh molekul ATP za vsako rotacijo cikla.
Vendar proces nastajanja sečnine zagotavlja energijo:
Med regeneracijo aspartata iz fumarata nastane NADH v fazi dehidrogeniranja malata, ki lahko zagotovi sintezo 3 makroergičnih vezi.
Med oksidativnim razkrojem glutamata nastaja tudi NADH v različnih organih, ki lahko zagotovijo sintezo 3 makroergičnih vezi.
Iz zgornjih reakcij je razvidno, da se strupeni amonijak spremeni v neškodljivo sečnino. V tem primeru se eden od atomov sečnine dušika tvori iz amoniaka, drugi pa iz aspartata.
24.4.1. Biosinteza sečnine- glavni način nevtralizacije amoniaka. Sečnina se v jetrnih celicah sintetizira v ciklu ornitina. To reakcijsko zaporedje sta odkrila H. Krebs in K. Hanseleit leta 1932. Po sodobnih konceptih cikel sečnine vključuje zaporedje petih reakcij.
V mitohondriji jetrnih celic se pojavita dve začetni reakciji biosinteze sečnine.
Kasnejše reakcije potekajo v citoplazmi jetrnih celic.
Splošna shema ornitinskega cikla je prikazana na sliki 24.2:
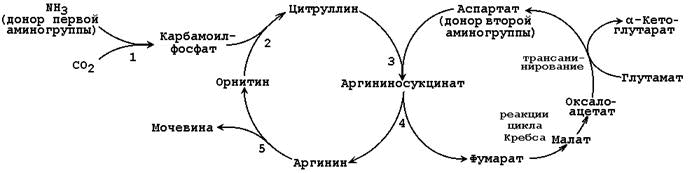
Slika 24.2.Shema ornitinskega cikla in njegova povezanost s pretvorbami fumarne in asparaginske kisline.
Številke označujejo encime, ki katalizirajo reakcije ornitinskega cikla: 1 - karbamoilfosfat sintetaza; 2 - ornitin karbamoiltransferaza; 3 - argininosukcinatna sintetaza; 4 - argininosukcinat; 5 - arginaza.
24.4.2. Cikel ornitina je blizu razmerje s ciklom trikarboksilne kisline:
- sprožilne reakcije cikla sečnine in reakcije CTK potekajo v mitohondrijskem matriksu;
- dobava CO2 in ATP, ki sta potrebna za tvorbo sečnine, zagotavlja delovanje CTK;
- v ciklu sečnine nastane fumarat, ki je eden od substratov CTK. Fumarati hidrati do malata, ki se oksidira v oksaloacetat. Oksaloacetat lahko opravi transaminacijo v aspartat; ta aminokislina sodeluje pri tvorbi arinosukcinata.
24.4.3. Uravnavanje aktivnosti encimov cikel poteka v glavnem na ravni karbamoilfosfat sintetaze, ki je neaktivna, če ni njenega alosteričnega aktivatorja - N-acetil-glutamat. Koncentracija slednjega je odvisna od koncentracije predhodnikov (acetil-CoA in glutamata), pa tudi arginina, ki je alosterni aktivator N-acetilglutamat sintaze:
Acetil-CoA + glutamatN-acetilglutamat + CoA-SH
Koncentracija encimov v ciklu ornitina je odvisna od vsebnosti beljakovin v prehrani. Ob prehodu na prehrano, bogato z beljakovinami, se v jetrih poveča sinteza encimov ornitinskega cikla. Po vrnitvi k uravnoteženi prehrani se koncentracija encimov zmanjša. V pogojih stradanja se ob razpadu tkivnih beljakovin in uporabi aminokislin kot energetskih substratov poveča proizvodnja amoniaka, poveča se koncentracija encimov ornitinskega cikla.
24.4.4. Motnje ornitinskega cikla. Metabolične motnje so znane zaradi delne blokade vsakega od 5 encimov, ki katalizirajo reakcijo sinteze sečnine v jetrih, kot tudi N-acetilglutamat sintaze. Te genetske okvare so očitno delne. Popolna blokada katere koli faze cikla sečnine v jetrih se zdi nezdružljiva z življenjem, ker ni drugega učinkovitega načina za odstranitev amoniaka.
Pogost znak vseh motenj sinteze sečnine je povečana vsebnost NH4 + v krvi ( hiperammonemija) Najtežje klinične manifestacije opazimo z napako v encimu karbamoilfosfat sintetaza. Klinični simptomi, ki so skupni vsem motnjam cikla sečnine, vključujejo bruhanje, moteno motorično koordinacijo, razdražljivost, zaspanost in duševno zaostalost. Če se bolezen ne diagnosticira, potem smrt hitro nastopi. Pri starejših otrocih so manifestacije bolezni povečana razdražljivost, povečanje velikosti jeter in averzija do hrane z visoko vsebnostjo beljakovin.
Laboratorijska diagnoza bolezni vključuje določanje amoniaka in presnovkov ornitinskega cikla v krvi, urinu in cerebrospinalni tekočini; v težkih primerih se zatečejo k biopsiji jeter.
Z omejevanjem beljakovin v prehrani opazimo znatno izboljšanje, medtem ko je mogoče preprečiti številne možganske motnje. Dieta z nizko vsebnostjo beljakovin vodi do zmanjšanja vsebnosti amoniaka v krvi in \u200b\u200bdo izboljšanja klinične slike pri blagih oblikah teh dednih motenj. Hrano je treba jemati pogosto, v majhnih obrokih, da se izognemo močnemu povečanju ravni amoniaka v krvi.
24.4.5. Klinična in diagnostična vrednost določitve sečnine v krvi in \u200b\u200burinu. V krvi zdrave osebe je vsebnost sečnine 3,33 - 8,32 mmol / L. Na dan z urinom se izloči 20 - 35 g sečnine.
Spremembe sečnine v krvi pri boleznih so odvisne od razmerja procesov njegove tvorbe v jetrih in izločanja z ledvicami. Povečanje sečnine v krvi (hiperazotemija) opazimo z odpovedjo ledvic, zmanjšanje - z odpovedjo jeter, z dieto z malo beljakovin.
Povečano izločanje sečnine v urinu opazimo pri uživanju hrane z veliko beljakovin, pri boleznih, ki jih spremlja povečan katabolizem beljakovin v tkivih, ob jemanju nekaterih zdravil (na primer salicilatov). Zmanjšanje izločanja sečnine v urinu je značilno za bolezni in toksične lezije jeter, bolezni ledvic, ki jih spremlja kršitev njihove filtracijske sposobnosti.
Amonijak je eden končnih produktov izmenjave snovi, ki vsebujejo dušik. To je sestavina ostanka dušikove frakcije krvnega seruma (skupaj s sečnino, sečno kislino, kreatininom, indikanom). V krvi je koncentracija amoniaka nizka - 25-40 mikromol / l. V višjih koncentracijah ima toksičen učinek na telo.
Amonijak je strupen predvsem za centralni živčni sistem. Toksičnost amoniaka je povezana z njegovo zmožnostjo motenja delovanja CLK, ker NH 3 odstranjuje iz CLK-ketoglutarata:
- KG + NH3 + NADH. H + Glu + OVER + + H 2 O.
Na koncu reduktivna aminacija - keto - glutarat, v celicah centralnega živčnega sistema se zmanjša aktivnost CLK, kar posledično zavira aktivnost aerobne oksidacije glukoze. Posledično je proizvodnja energije motena in razvija se hipoenergetsko stanje, ker glukoza je glavni vir energije za možgane.
NH 3 nastala med naslednjimi procesi :
1) oksidativno razkrojevanje aminokislin - to je glavna pot proizvodnje NH 3;
deaminacija biogenih aminov;
razmaščevanje purinskih baz (adenin, gvanin);
katabolizem nukleotidov pirimidina.
V možganih je glavni vir nastajanja NH3 deaminacija AMP v inozin monofosfat (IMP):
AMP + H 2 Oh IMP +NH 3 .
Encim, ki katalizira to reakcijo, je adenozin deaminaza.
Amoniak se s krvjo prevaža v jetrih in ledvicah za nevtralizacijo v sestavi aminokislin, med katerimi so glavne glutamin, asparagin, alanin.
Nevtralizacija NH 3 se pojavi skoraj takoj po nastanku, ker v tkivih se takoj vključi v sestavo aminokislin, predvsem glutamina. Vendar pa za nadaljnjo razstrupljanje in izločanje amoniaka obstajajo biokemični procesi v jetrih in ledvicah, ki so glavni načini nevtralizacije NH 3.
Dodelite naslednje mehanizmi za dekontaminacijo NH 3 :
1 ) reduktivna aminacija -ketoglutarata;
2 ) tvorba amidov aminokislin - asparagin in glutamin;
3 ) tvorba amonijevih soli v ledvicah;
4 ) sinteza sečnine.
V tkivih je amoniak podvržen takojšnji nevtralizaciji. To dosežemo s kombinacijo procesov ( 1 ) in ( 2 ).
Redukcijska aminacija –Ketoglutarat:
NH 3 + –KG + NADN . N + Glu + NAD + N 2 O.
Encim - glutamat dehidrogenaza
Ta postopek zahteva znatne koncentracije - KG. Da se prepreči prekomerni odhodki - KG in delovanje CLK ne bi motili, se - KG napolni zaradi pretvorbe PVKOA - KG.
2 )Tvorba amidaJe pomemben pomožni mehanizem za nevtralizacijo NH 3 v tkivih z njegovo vezavo na Glu ali Asp.
Asp + ATP +NH 3 ASN + AMP + FF nn
Encim - asparagin sintaza
Glu + ATP +NH 3 Gln + AMP + FF nn
Encim - glutamin sintaza
Ta proces je najbolj aktiven v centralnem živčnem sistemu, mišicah, ledvicah in jetrih (za vzdrževanje notranje koncentracije NH 3). Večinoma glnje transportna oblika netoksičnega NH 3 iz možganov, mišic in drugih tkiv. Glutamin zlahka prodre v membrano, ker pri fiziološkem pH nima naboja. Med vadbo alanin aktivno prenaša NH 3 iz mišic v jetra. Poleg tega velika količina alanina vsebuje kri, ki priteče iz črevesja. Ta alanin se pošlje tudi v jetra zaradi glukoneogeneze.
3 ) Gln in ASN s pretokom krvi vstopata v ledvice, kjer se podvržeta hidrolizi s pomočjo posebnih encimov - glutaminaze in asparaginaze, ki ju najdemo tudi v jetrih:
Asn + H20 OAAsp + NH3.
Gln + H20 OGGlu + NH3.
Osvobojeno v tubulih ledvic NH 3 se nevtralizira z nastanek amonijevih soli,ki se izločajo z urinom:
NH3 + H + + Cl - NH4Cl.
4 )Sinteza sečnine- To je glavni način za nevtralizacijo amoniaka. Sečnina predstavlja 80% izločenega dušika.
Proces nastajanja sečnine se pojavi v jetrih in je ciklični proces, imenovan „ ornitinski cikel "(Krebs - cikel Hanselight).
V ciklu sodelujeta dve aminokislini, ki nista del beljakovin, ornitin in citrulin ter dve proteinogeni aminokislini, arginin in asparagin.
Postopek vključuje pet reakcij: prva dva se nadaljujeta v mitohondrijih, preostala pa v citosolu hepatocitov. Nekateri encimi, ki tvorijo sečnino, najdemo v možganih, rdečih krvnih celicah in srčni mišici, vendar je celoten niz encimov le v jetrih.
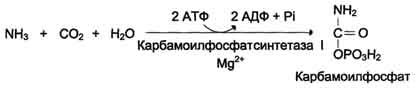
І reakcijaAli je sinteza karbamoil fosfata:
SO 2 + NH 3 + 2ATPNH 2 –CO - F + 2ADP + F n.
Encim - karbamoil fosfat sintazaІ (mitohondrijski). Obstaja tudi karbamoilfosfat sintaza II (v citosolu), ki sodeluje pri sintezi nukleotidov pirimidina.
Karbamoilfosfat sintaza I je regulativni encim, za katerega aktivator je N–Acetilglutamat.
ІІ reakcija- vključitev karbamoil fosfata v ciklični postopek. V tej reakciji se kondenzira z ornitinom), kar povzroči nastanek citrulina (reakcija se pojavi tudi v mitohondrijih).
III reakcija- tvorba arginin sukcinata. To je druga reakcija, ki uporablja energijo ATP.
IV reakcija- cepitev argininskega sukcinata s tvorbo arginina in fumarata. Slednji lahko vstopi v centralno nadzorno komisijo in tako izboljša svoje delo. T.O. To je anaplerotična (obnavljajoča) reakcija za CLK.
V reakcija -regeneracija ornitina s nastanek sečnine.
Shema sinteze sečnine
CO 2 + NH3 + 2ATPkarbamoilfosfat + 2ADP + F n
NH2-CO - NH2
 (sečnina)Ornitin
(sečnina)Ornitin
5 2
ArgininCitrulin
4 3 ATP
Fumarate AMF
Arginin sukcinatFf n
Encimi:
1 - karbamoil fosfat sintaza;
2 - ornitinkarbamoiltransferaza;
3 - argininosukcinatna sintaza;
4 - argininosukcinatna liza;
5 - arginaza(močna zaviralca encima sta ornitin in lizin, ki tekmujeta z argininom, aktivatorji - Ca 2+ in Mn 2+).
Ornitin, ki se med ciklom obnovi, lahko sproži nov cikel sečnine. Ornitin je po svoji vlogi podoben oksaloacetatu v CLK. Za dokončanje enega cikla so potrebni 3 ATP, ki se uporabljajo v 1. in 3. reakciji.
Cikel ornitina je tesno povezan s CLK.
Shematično lahko razmerje predstavljamo na naslednji način:
Ornith-CO 2
nov TsLK
cikel
Fumarate ATP
Aspartat
To je Krebsovo "dvokolesno kolo" - niti enega kolesa ni mogoče "zasukati" brez ustreznega delovanja drugega.
Izločanje sintetizirane sečnine zagotavljajo ledvice. Na dan se sprosti 20-35 g sečnine. Ko spreminjamo količino beljakovin v hrani, da bi ohranili dušikovo ravnovesje, se hitrost sinteze sečnine v telesu spremeni:
beljakovine s hrano sinteza encimov cikla synthesis sinteza sečnine,
če beljakovinski katabolizem sinteza sečnine in količina
izhodni dušik.
Med postom in diabetesom mellit opazimo povečan katabolizem beljakovin in posledično povečano izločanje sečnine.
Pri boleznih jeter, ki jih spremlja motena sinteza sečnine, se koncentracija amoniaka v krvi poveča (hiperammonemija) in posledično se razvije jetrna koma.
Amonijak nastane kot posledica razgradnje aminokislin, amidov, aminov, pa tudi nukleotidov. Glavni vir amonijaka je oksidacija glutamata glutamat dehidrogenaza, ki se pojavlja v skoraj vseh telesnih tkivih.
Ker je amonijak v procesu evolucije zelo strupena snov, zlasti za živčni sistem, so se v človeškem telesu razvili mehanizmi njegove nevtralizacije. Raven amoniaka v krvi običajno ne presega 50 μmol / L. Strupenost za amoniak je posledica več dejavnikov. V tkivih in telesnih tekočinah je amoniak večinoma v obliki amonijevega kationa (NH 4 +), ki slabo prodre skozi membrane. Toda približno 1% prostega amonijaka je v ravnovesju z NH4 +, zlahka prehaja skozi membrane. V mitohondrijah amonijak med reakcijo z alfa-ketoglutaratom v reakciji z reverzno glutamat dehidrogenazo tvori glutamat. Visoka vsebnost amoniaka spodbuja odtok alfa-ketoglutarata iz cikla citronske kisline in posledično zmanjšanje mitohondrijske oksidacije in sinteze ATP, najbolj občutljive možganske celice pa se zaradi aerobne razgradnje glukoze skoraj v celoti oskrbijo z energijo.
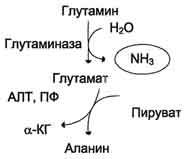
Glavni končni produkti presnove amoniaka pri živalih in ljudeh so sečnina, katere nastanek nastane v jetrih. Amoniak se v perifernih tkivih prenaša v jetra in ledvice v obliki glutamina. Ta aminokislina nastane iz glutaminske kisline z dodatkom amoniaka pod delovanjem glutamin sintetaze.
Glutamin je nevtralna, nestrupena spojina, ki za razliko od glutamata zlahka prehaja skozi celične membrane. V možganih je delovanje glutamin sintetaze združeno z delovanjem glutamat dehidrogenaze, ki deluje predvsem v smeri sinteze glutamata z alfa-ketoglutaratom. Iz možganov glutamin prosto difundira v kri ali cerebrospinalno tekočino, hkrati pa izloči dve molekuli strupenega amoniaka.
Glutamin sintetaza je aktivna tudi v jetrih. Tu vzdržuje znotrajcelično koncentracijo amoniaka na ravni, ki ne dosega meja toksičnosti. V jetrih in ledvicah glutaminaza hidrolizira glutaminazo do glutamata in prostega amoniaka. Nevtralna aminokislina, alanin, sodeluje pri transportu amoniaka iz mišic v jetra. Med intenzivnim mišičnim delom se del aminokislin s glukoneogenezo pretvori v glukozo. V teh pogojih se v mišicah tvori znatna količina amoniaka. Amonijak medsebojno deluje z alfa-ketoglutaratom, tvori se glutamat. Slednji medsebojno deluje s piruvatom, katerega vsebnost se med delovanjem poveča zaradi povečane glikolize. Med piruvatom in glutamatom pride do reakcije transaminacije.
Alanin se s krvjo prenese v jetra, kjer pod delovanjem alanin aminotransferaze prenese amino skupino alfa-ketoglutarata, nato pa se amoniak sprosti iz glutamata v reakcijo glutamat dehidrogenaze. S piruvatom v jetrih se resintezira glukoza, ki se ponovno uporablja v mišicah.
Proces ciklične sinteze sečnine sta leta 1932 odkrila G. Krebs in K. Henselight. V ciklu sodelujeta dve aminokislini, ki nista del beljakovin (ornitin in citrulin), in dve aminokislini, ki ju vsebujeta beljakovine (arginin in aspartat). Krebs in Henselight sta odkrila, da se hitrost sinteze sečnine močno poveča, ko se medu dodajo ornitin, arginin ali citrulin. Na podlagi teh dejstev je Krebs predlagal shemo sinteze sečnine. Cikel je sestavljen iz 5 reakcij, od katerih vsaka katalizira ločen encim.
Cikel sečnine in cikel citronske kisline sta tesno povezana. Tako dobava CO2 in ATP, ki sta potrebna za tvorbo sečnine, zagotavljamo s ciklom citronske kisline. Fumarna kislina, ki nastane s cepitvijo argininosukcinata, s sodelovanjem encimov cikla citronske kisline se pretvori iz malata v oksaloacetat, slednji pa v reakciji transaminacije z glutamatom ponovno sproži aspartat. Neposredni viri dušikovih atomov v molekuli sečnine so amoniak in aspartat. Oboje je mogoče dobiti iz glutamata: amoniak - z oksidativnim razkrojem, aspartat - transaminacija. Zahvaljujoč transaminaciji z alfa-ketoglutaratom so vse aminokisline sposobne aminokislinam dati sečnino, končni produkt katabolizma aminokislin v človeškem telesu.
V. IZMENJAVA AMONIJE
A. VIRI AMONIJE V CELIKAH
Katabolizem aminokislin v tkivih se pojavlja nenehno s hitrostjo 100 g / dan. V tem primeru se zaradi deaminacije aminokislin sprosti velika količina amoniaka.
Shema A
Shema B
Shema B
Med deaminacijo biogenih aminov in nukleotidov nastanejo bistveno manjše količine le-tega. Glavni viri amoniaka v celicah so predstavljeni v preglednici. 9-3.
Del amoniaka nastaja v črevesju.kot posledica delovanja bakterij na beljakovine v hrani ( propadanje beljakovin včrevesja) in vstopi v portalno vensko kri. Koncentracija amoniaka v krvi portalne vene je bistveno višja kot v splošnem krvnem obtoku. V jetrih se zadrži velika količina amoniaka, ki ohranja nizko vsebnost le-tega v krvi. Koncentracija amoniaka v krvi običajno redko presega 0,4-0,7 mg / l (ali 25-40 mikromol / l). Pri fizioloških pH vrednostih amonijak v krvi in \u200b\u200bcitosolu celic prehaja v amonijev ion - NH4 +, količina neioniziranega NH3 je majhna (~ 1%).
Amonijak je strupena spojina. Že rahlo povečanje njegove koncentracije škodljivo vpliva na telo in zlasti na centralni živčni sistem. Tako povečanje koncentracije amoniaka v možganih na 0,6 mmol povzroči epileptične napade. Simptomi hiperammonemije so tremor, moten govor, slabost, bruhanje, omotica, napadi in izguba zavesti. V hudih primerih se razvije koma s smrtnim izidom.
Mehanizem toksičnih učinkov amoniakana možgane in celotno telo je očitno povezano z njegovim delovanjem na več funkcionalnih sistemov.
- Amonijak zlahka prodre skozi membrane v celice in v mitohondrijih preusmeri reakcijo, katalizirano z glutamat dehidrogenazo, v tvorbo glugamata:
α-ketoglutarat + NADH + H + + NH3 → glutamat + NAD +.
Znižanje koncentracije α-ketoglutarata povzroči:
- zatiranjeizmenjava aminokislin (transminatorske reakcije) in posledično sinteza nevrotransmiterjev (acetilholina, dopamina itd.) iz njih;
- hipoenergetsko stanje vkot posledica zmanjšanja hitrosti CTK
Tabela 9-3. Glavni viri amoniaka
| Vir | Postopek | Encimi | Lokalizacija procesa |
| Aminokisline | Posredno razkuževanje (glavna pot deaminacije aminokislin) | Aminotransferaze, PF glutamat dehidrogenaza, NAD + | Vse tkanine |
| Oksidativno raztapljanje glutamata | Glutamat dehidrogenaza, NAD + | Vse tkanine | |
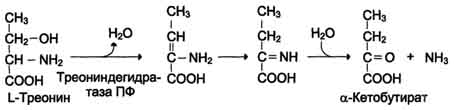
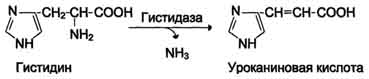
| Neoksidirano razkuževanje Gis, Ser, Tre | Histidaza-serin, treonin dehidratataza, PF | V glavnem jetra | |
| Oksidativno razkrojevanje aminokislin (nepomemben način razkroja) | L-aminokislinska oksidaza, FMN | Jetra in ledvice | |
| Biogeni amini | Oksidativna deaminacija (pot inaktivacije biogenih aminov) | Amino oksidaze, FAD | Vse tkanine |
| AMF | Hidrolitično razmaščevanje | AMP deaminaza | Intenzivno delujoča mišica |
Nezadostnost α-ketoglutarata vodi do zmanjšanja koncentracije presnovkov CTK, kar povzroči pospešitev sinteze oksaloacetata iz piruvata, ki ga spremlja intenzivno uživanje CO 2. Povečana tvorba in poraba ogljikovega dioksida med hiperammonemijo je še posebej značilna za možganske celice.
- Povečanje koncentracije amoniaka v krvi pH preusmeri na alkalno stran (povzroči alkaloza) To pa posledično povečuje afiniteto hemoglobina do kisika, kar vodi v tkivno hipoksijo, kopičenje CO 2 in hipoenergetsko stanje, zaradi katerega možgani večinoma trpijo.
- Visoke koncentracije amoniaka spodbujajo sintezo glutaminaiz glutamata v živčnem tkivu (s sodelovanjem glutamin sintetaze):
Glutamat + NH3 + ATP → glutamin + ADP + H 3 P0 4.
- Kopičenje glutamina v celicah nevroglije vodi v povečanje osmotskega tlaka v njih, otekanje astrocitov in v visokih koncentracijah lahko povzroči možganski edem. Zmanjšanje glutamatamoti presnovo aminokislin in zlasti nevrotransmiterjev sinteza y-amino-maslene kisline(GABA), glavni zavorni posrednik. Ob pomanjkanju GABA in drugih mediatorjev je motenje prevodnosti živčnega impulza moteno, pojavijo se krči.
- Ion NH 4 + praktično ne prodira skozi citoplazemske in mitohondrijske membrane. Presežek amonijevega iona v krvi lahko moti transmembranski prenos monovalentnih kacij Na + in K +, ki se konkurira z njimi za ionske kanale, kar vpliva tudi na prevod živčnih impulzov.
B. Vezava (nevtralizacija) amoniaka
Visoka intenzivnost procesov razkroja aminokislin v tkivih in zelo nizka raven amoniaka v krvi kažeta na to, da se amonijak v celicah aktivno veže s tvorbo nestrupenih spojin, ki se izločajo iz telesa z urinom. Te reakcije lahko štejemo za reakcije nevtralizacije amoniaka. Več vrst takšnih reakcij je bilo ugotovljenih v različnih tkivih in organih.
Glavna reakcija vezave na amoniak, ki se pojavi v vseh telesnih tkivih, je
sinteza glutamina z glutamin sintetazo:
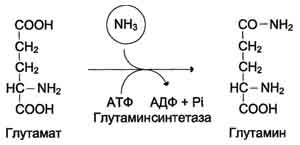
Glutamin sintetaza je lokalizirana v mitohondrijah celic, za delovanje encima je potreben kofaktor, ioni Mg 2+. Glutamin sintetaza je eden glavnih regulatornih encimov za presnovo aminokislin in jo alostericno zavira AMP, glukoza-6-fosfat, pa tudi Gly, Ala in His.
Glutamin se zlahka prevaža skozi celične membrane z olajšanjem difuzije (glutamat je mogoč le aktivni transport) in vstopi v kri iz tkiv. Glavna oskrbovalna tkiva: glutamin so mišice, možgani in jetra. S pretokom krvi se glutamin prevaža v črevesju in ledvicah.
V črevesnih celicahpod delovanjem encima glutaminaze pride do hidroliznega sproščanja amidnega dušika v obliki amoniaka:
Glutamat, ki nastane v reakciji, je podvržen transaminaciji s piruvatom. Os-amino skupina glutaminske kisline se prenese v sestavo alanina (slika 9-10). Velike količine alanina vstopijo v portalno veno iz črevesja in jih absorbirajo jetra. Približno 5% nastalega amonijaka se odstrani kot del zalega, majhen del prehaja skozi portalno veno v jetra, preostalih ~ 90% pa se izloči z ledvicami.
V ledvicahpride tudi do hidrolize glutamina pod delovanjem glutaminaze z nastankom amoniaka. Ta postopek je eden od mehanizmov uravnavanja kislinsko-baznega ravnovesja v telesu in ohranjanja najpomembnejših kationov za vzdrževanje osmotskega tlaka. Ledvična glutaminaza znatno povzroči acidozo, nastali amoniak nevtralizira kisle presnovne produkte in se izloči v obliki amonijevih soli z urinom (slika 9-11). Ta reakcija ščiti telo pred prekomerno izgubo Na + in K + ionov, ki se lahko uporabljajo tudi za odstranjevanje anionov in se izgubijo. Z alkalozo se količina glutaminaze v ledvicah zmanjšuje.
Na dan se tvori in izloči približno 0,5 g amonijevih soli na dan.
Visoka raven glutamina v krvi in \u200b\u200benostavnost njegovega vstopa v celice določata uporabo glutamina v številnih anaboličnih procesih. Glutamin je glavni darovalec dušika v telesu.Glutamin amidni dušik se uporablja za sintezo purinov in pirimidinov.
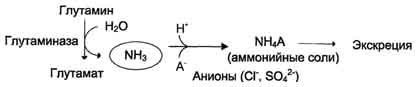
Sl. 9-11. Presnova dušika v glutamin amidu v ledvicah.
nukleotidi, asparagin, amino sladkorji in druge spojine (slika 9-12).
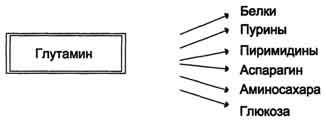
Upoštevati je mogoče še eno reakcijo nevtralizacije amoniaka v tkivih sinteza asparaginapod vplivom asparagin sintetaze.
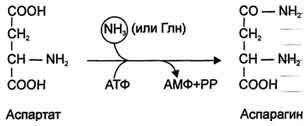
Obstajata 2 izoformi tega encima - od glutamina in od amoniaka, ki uporabljata različne darovalce amidnih skupin. Prve delujejo v živalskih celicah, slednje prevladujejo v bakterijskih celicah, vendar je prisotno tudi pri živalih. Vendar se tak način nevtralizacije amoniaka v človeških celicah uporablja redko in zahteva tudi več energije (energije dveh makroergičnih vezi) kot sinteza glutamina.
Najpomembnejše količine amoniaka nevtralizirajo v jetrih sinteza sečnine.V prvi reakciji postopka se amonijak veže na ogljikov dioksid in tvori karbamoil fosfat, porabi pa se 2 molekuli ATP. Reakcija se pojavi v mitohondrijih hepatocitov pod delovanjem encima karbamoilfosfat sintetaza I. Karbamoilfosfat sintetaza II je lokalizirana v citosolu celic vseh tkiv in sodeluje pri sintezi nukleotidov gsrimidina (glejte poglavje 10). Karbamoil fosfat se nato vključi v ornitinski cikel in se uporablja za sintezo sečnine.
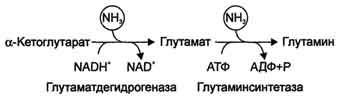
V možganih in nekaterih drugih organih lahko pušča. reduktivna aminacija α -ketoglutaratpod delovanjem glutamat dehidrogenaze, ki katalizira reverzibilno reakcijo. Vendar pa se ta način nevtralizacije amoniaka v tkivih slabo uporablja, saj glutamat dehidrogenaza katalizira predvsem deaminacijo glutamata. Čeprav je ob upoštevanju poznejše tvorbe glutamina reakcija koristna za celice, saj spodbuja vezavo 2 molekul NH 3 naenkrat.
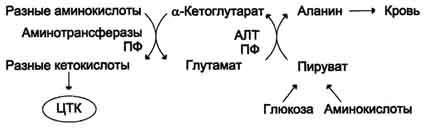
Iz mišic in črevesja se presežek amoniaka izloči predvsem v obliki alanina. Ta mehanizem je nujen, saj je aktivnost glutamata dehidrogenaze v mišicah majhna in je posredno razkrojitev aminokislin neučinkovito. Zato v mišicah obstaja še en način izločanja dušika. Tvorba alanina v teh organih je lahko predstavljena z naslednjo shemo (glej shemo spodaj).
Amino skupine različnih aminokislin se s transaminacijo prenašajo v piruvat, katerega glavni vir je proces oksidacije glukoze.
Mišice izločajo veliko alanina zaradi velike mase in aktivne porabe.
Shema
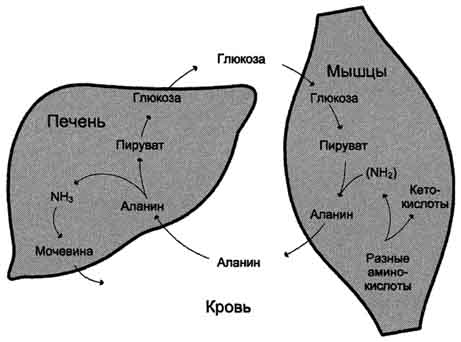
glukozo med fizičnim delom in tudi zato, ker del energije, ki jo dobijo zaradi razpada aminokislin. Nastali alanin vstopi v jetra, kjer je podvržen posrednemu razkroju. Sproščeni amonijak se nevtralizira in v glukoneogenezo je vključen piruvat. Glukoza iz jeter vstopi v tkiva in tam v procesu glikolize ponovno oksidira v piruvat (sl. 9-13).
Tvorba alanina v mišicah, prenos v jetra in prenos glukoze, ki se sintetizira v jetrih, nazaj v mišice cikel glukoze-alanina,katerih delo je povezano z delom cikla glukoza-laktat (glejte poglavje 7).
Nabor osnovnih procesov presnove amoniaka v telesu je predstavljen na sl. 9-14. Glutamat dehidrogenaza in glutamin sintetaza sta prevladujoča encima pri izmenjavi amoniaka.
B. cikel ornitina
Urea je glavni končni produkt presnove dušika,v sestavi katere se do 90% vsega dušika izloči iz telesa (slika 9-15). Izločanje sečnine je običajno ∼25 g / dan.
S povečanjem količine beljakovin, zaužitih s hrano, se povečuje izločanje sečnine. Urea se sintetizira le v jetrih, kar je bilo ugotovljeno v poskusih I.D. Pavlova. Poškodbe jeter in kršitev sinteze sečnine vodijo v povečanje vsebnosti amoniaka in aminokislin (predvsem glutamina in alanina) v krvi in \u200b\u200btkivih.
V 40. letih 20. stoletja sta nemška biokemičara G. Krebs in K. Henseleit ugotovila, da je sinteza sečnine cikličen postopek, sestavljen iz več stopenj, katerih ključna spojina je zaključek cikla ornitin. Zato se imenuje postopek sinteze sečnine "ornitinski cikel"ali "Cikel Krebs-Hanseleit".
1. Reakcije sinteze sečnine
Urea (sečnina) - popoln amid ogljikove kisline - vsebuje 2 dušikova atoma. Vir
enood tega je amoniakki se v jetrih veže na tvorbo ogljikovega dioksida
Sl. 9-14. Izmenjava amoniaka. Glavni vir amoniaka so aminokisline. Večina nastalega amoniaka se v jetrni cikli nevtralizira v jetrnih organih in izloči kot sečnina. Glavna reakcija nevtralizacije amoniaka v tkivih je sinteza glutamina, ki se nato uporablja v anaboličnih procesih in za nevtralizacijo snovi v jetrih. Encima glutamat dehidrogenaza in glutamin sintetaza sta regulativna in določata hitrost tvorbe in nevtralizacije amoniaka.
karbamoil fosfat pod delovanjem karbamoil fosfat sintetaze I (glej shemo A spodaj).
V naslednji reakciji argininosukcinatna sintetaza veže citrulin z aspartatom in tvori argininosukcinat (argininosukcinska kislina). Ta encim potrebuje Mg 2+ ione. Za reakcijo se porabi 1 mol ATP, vendar se porabi energija dveh makroergičnih vezi. Aspartat - vir drugega atoma dušikovega sečnine(glejte shemo A na strani 483).
Shema A
Shema B
Arginin se pod delovanjem arginaze podvrže hidrolizi, pri čemer nastanejo ornitin in sečnina. Kofaktorji arginaze so Ca 2+ ali Mn 2+ ioni. Visoke koncentracije ornitina in lizina, ki sta strukturna analoga arginina, zavirata aktivnost tega encima:
Nastali ornitin medsebojno deluje z novo molekulo karbamoil fosfata in cikel se zapre.
Prvi dve reakciji procesa se pojavita v mitohondrijih hepatocitov. Nato se citrulin, ki je produkt teh reakcij, prenese v citosol, kjer se izvedejo nadaljnje transformacije (slika 9-16).
Skupna enačba za sintezo sečnine:
SO 2 + NH 3 + aspartat + 3 ATP + 2 Н 2 О → sečnina + fumarat + 2 (ADP + N 3 Р0 4) + AMP + H 4 P 2 O 7.
Amoniak, ki ga uporablja karbamoilfosfat sintetaza I, se v jetra dovaja s krvjo iz portalne vene. Vloga drugih virov, vključno s hitro razgradnjo glutamin eta v jetrih, je bistveno manjša.
Aspartat, potreben za sintezo argininocinata, nastane v jetrih s transaminacijo.
Shema B
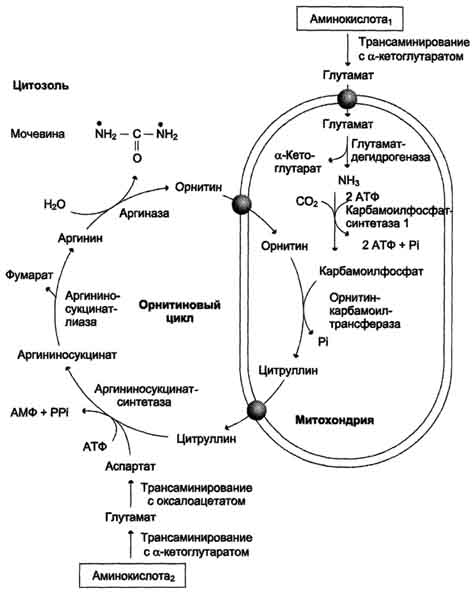
Sl. 9-16. Krebs-Hanseleitov ornitinski cikel. Oksidativna deaminacija glutamata se pojavi v mitohondrijih. Encimi iz ornitinskega cikla se porazdelijo med mitohondrije in citosol. Zato je potreben transmembranski prenos glutamata, citrulina in ornitina s pomočjo posebnih translokaz. Diagram prikazuje poti vgradnje dušika dveh različnih aminokislin (aminokislina 1 in aminokislina 2) v molekulo sečnine: • ena amino skupina - v obliki amoniaka v mitohondrijskem matriksu; • Drugo amino skupino oskrbuje citosol aspartat.
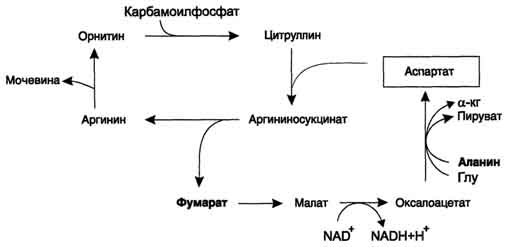
alanin z oksaloacetatom. Alanya prihaja predvsem iz mišic in celic črevesja. Vir oksaloacetata, potreben za to reakcijo, se lahko šteje za pretvorbo fumarata, ki nastane v reakcijah ornitinskega cikla. Kot posledica dveh reakcij citratnega cikla se fumarat pretvori v oksaloacetat, iz katerega se s transaminacijo tvori aspartat (slika 9-17). Tako je z ornitinskim ciklom seznanjen cikel regeneracije aspartata iz fumarata.Piruvat, ki se v tem ciklu tvori iz alanina, se uporablja za glukoneogenezo.
Drugi vir aspartata za ornitinski cikel je transaminacija glutamata z oksaloacetatom.
2. Energetska bilanca procesa
V reakcijah ornitinskega cikla se porabijo štiri makroergične vezi treh molekul
ATP za vsako vrtenje cikla. Vendar pa postopek pretvorbe aminokislin v ostanke in sečnino vsebuje načine, kako nadomestiti stroške energije:
- kadar je fumarat vključen v CCC, se na stopnji dehidrogeniranja malata tvori NADH, ki zagotavlja sintezo 3 molekul ATP (slika 9-18);
- med oksidativnim deaminacijo glutamata v različnih organih nastaja tudi NADH - še 3 molekule ATP.
Stroški energijese pojavljajo tudi med transmembranskim transportom snovi, povezanih s sintezo in izločanjem sečnine (slika 9-18). Prvi dve reakciji ornitinskega cikla se pojavita v mitohondrijih, naslednji trije pa v citosolu. Citrulin, ki nastane v mitohondrijih, se mora prenesti v citosol, ornitin, ki nastane v citosolu, pa se mora prenašati v mitohondrije. Poleg tega v ledvicah pride do prenosa sečnine iz krvi v urin z aktivnim transportom zaradi gradienta natrijevih ionov, ki ga ustvarja K +, Na + -ATPaza, kar je povezano tudi s porabo energije.
Celoten sklop encimov ornitinskega cikla najdemo le v hepatocitih. Ločeni encimi iz ornitinskega cikla najdemo ne le v jetrih, ampak tudi v drugih celicah. Enterociti imajo na primer karbamoilfosfat sintetazo I in ornitinkarbamoil transferazo, zato je mogoče sintetizirati citrulin. V ledvicah so našli argininosukcinatno sintetazo in argininosukcinatno lizo. Citrulin, ki se tvori v enterocitih, lahko vstopi v ledvice in se tam spremeni v arginin, ki se transportira v jetra in hidrolizira z arginazo. Aktivnost teh encimov, razpršenih v različnih organih, je veliko nižja kot v jetrih.
3. Biološka vloga ornitinskega cikla
Krebs-Hanseleit
Cikel ornitina v jetrih opravlja 2 funkciji:
- pretvorba dušika aminokislin v sečnino, ki se izloča in preprečuje kopičenje strupenih produktov, predvsem amoniaka;
- sinteza arginina in polnjenje njegovega sklada v telesu.
Regulativne faze postopka so sinteza karbamoil fosfata, sinteza citrulina in končna stopnja, katalizirana z arginazo. Učinkovitost cikla ornitina z normalno prehrano ljudi in zmernimi fizičnimi napori je približno 60% njegove moči. Rezerva moči je potrebna, da se izognemo hiperammonemiji s spremembami količine beljakovin v hrani. Povečanje hitrosti sinteze sečnine se pojavi pri dolgotrajnem fizičnem delu ali dolgotrajnem stradanju, ki ga spremlja razpad tkivnih beljakovin. Nekatera patološka stanja, za katera je značilno intenzivno razgradnjo beljakovin
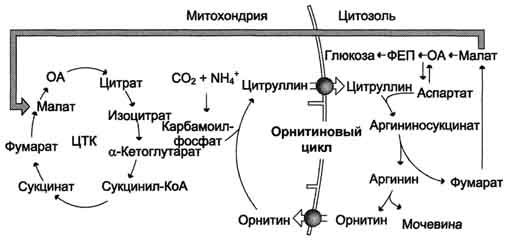
Sl. 9-18. Razmerje med ornitskim ciklom in splošno potjo katabolizma. Fumarat, ki nastane pri cepitvi argininosukcinata, se pretvori v malat, ki se nato prenese v mitohondrije, vključi v CTK in dehidrira, da nastane oksaloacetat. To reakcijo spremlja sproščanje 3 molekul ATP, ki kompenzirajo porabo energije za sintezo ene molekule sečnine.
tkiva (diabetes mellitus itd.) spremlja tudi aktivacija ornitinskega cikla. S čezmerno prehrano beljakovin se poveča število encimov ornitinskega cikla v jetrih, kar vodi v intenziviranje sinteze sečnine.
4. Hiperammonemija
Lahko pride do motenj reakcij nevtralizacije amoniaka povečan amoniak v krvi- hiperammonemija, ki strupeno vpliva na telo. Vzroki za hiperammonemijo so lahko genetska okvara encimov ornitinskega cikla v jetrih in sekundarna poškodba jeter kot posledica ciroze, hepatitisa in drugih bolezni. Znanih je pet dednih bolezni, ki jih povzroča napaka petih encimov ornitinskega cikla (tabela 9-4).
V literaturi so opisani primeri vseh teh dokaj redkih encimov, med katerimi je največ primerov hiperammonemije tipa II.
Kršitev ornitinskega cikla opazimo pri hepatitisu različnih etiologij in nekaterih drugih virusnih boleznih. Ugotovljeno je bilo na primer, da virusi gripe in druge akutne respiratorne virusne okužbe zmanjšujejo aktivnost karbamoilfosfat sintetaze I. Hiperammonemijo pogosto opazimo tudi pri cirozi in drugih boleznih jeter.
Zmanjšanje aktivnosti katerega koli encima za sintezo sečnine vodi v kopičenje substrata tega encima in njegovih predhodnikov v krvi. Torej, s pomanjkanjem argininosukcinatne sintetaze se vsebnost citrulina poveča (citrulinenemija); z napako arginaze - koncentracija arginina, argininosukcinata, citrulina itd. Pri hiperammonemiji tipa I in II se karbamoil fosfat kopiči v mitohondrijah in izstopi v citosol zaradi okvare ornitkarkarmoamotransferaze. To povzroči povečanje hitrosti sinteze nukleotidov pirimidina (zaradi aktivacije karbamoilfosfat sintetaze II), kar vodi do kopičenja orotata, uridina in uracila in njihovega izločanja z urinom. Vsebnost vseh presnovkov se poveča, stanje pacientov pa se poslabša s povečanjem količine beljakovin v hrani. Resnost poteka bolezni je odvisna tudi od stopnje zmanjšanja aktivnosti encimov.
Vse motnje cikla ornitina vodijo do občutnega povečanja koncentracije amoniaka, glutamina in alanina v krvi.
Hiperammonemijaspremlja pojav naslednjih simptomov:
- slabost, ponavljajoče bruhanje;
- omotica, krči;
- izguba zavesti, možganski edem (v hudih primerih);
- duševna zaostalost (v kronični prirojeni obliki).
Tabela 9-4. Dedne motnje cikla ornitina in njihove glavne manifestacije
| Bolezen | Poraz encim |
Vrsta dedovanja | Klinična manifestacije |
Presnovki | |
| kri | urin | ||||
| Hyperam- moniemija tip I |
Karbamoil fosfat sintetaza I |
Avtosomno recesivno |
V 24-48 urah po rojstvu kome je smrt | Gln Ala NH 3 |
Orotat |
| Hyperam- moniemija tip II |
Ornitin karbamoil transferaza |
X-vezano | Hipotenzija, zmanjšana toleranca za beljakovine | Gln Ala NH 3 |
Orotat |
| Citrul linemija |
Arginin sukcinat sintetaza |
Avtosomno recesivno |
Hiperammonemija je pri novorojenčkih huda. Pri odraslih - po nalaganju beljakovin | Citrulin NH 3 |
Citrulin |
| Arginin sukcin turija |
Arginin sukcinat liza |
Avtosomsko recesivno | Hiperamonije, ataksija, konvulzije, izpadanje las | Argini nesoljen NH 3 |
Argini nosucci nat, Gln, Ala, Liz |
| Hiperrar gininemija |
Arginase | Avtosomsko recesivno | Hiperargininemija | Apr NH 3 |
Apr Liz Ornitin |
Vsi simptomi hiperammonemije so manifestacija delovanja amoniaka na centralni živčni sistem (glej pododdelek IV, B zgoraj).
Za diagnozo različnih vrst hiperammonemije določimo vsebnost amoniaka v krvi, presnovke ornitinskega cikla v krvi in \u200b\u200burinu ter delovanje encimov v jetrnih biopsijah.
Glavni diagnostični simptom jepovečana koncentracija amoniaka v krvi. Vsebnost amonijaka v krvi lahko doseže 6000 μmol / L (normalno - 60 μmol / L). Vendar se v večini kroničnih primerov raven amoniaka lahko poveča šele po nalaganju beljakovin ali med akutnimi zapletenimi boleznimi.
Zdravljenjebolniki z različnimi okvarami ornitinskega cikla so usmerjeni predvsem v zmanjšanje koncentracije amoniaka v krvi zaradi prehrane z nizko vsebnostjo beljakovin, vnos keto analogov aminokislin v prehrano in spodbujanje izločanja amoniaka ob motenih reakcijah:
- z vezavo in izločanjem NH3 v sestavi fenilacetilglutamina in histurne kisline;
- povečanje koncentracije vmesnih presnovkov cikla (arginin, citrulin, glutamat), ki se tvorijo zunaj blokiranih reakcij (slika 9-19).
Fenilacetat, ki se daje bolniku s pomanjkanjem karbamoil fosfat sintetaze I kot prehransko dopolnilo, tvori fenilacetilglutamin, ki ga izločajo ledvice kot posledica njegove konjugacije z glutaminom. Hkrati se stanje bolnikov izboljša, saj se aktivira sinteza glutamina in koncentracija amoniaka v krvi zmanjša (sl. 9-19, A).
Podoben učinek ima vnos benzoata, ki veže molekulo glicina. Nastala kisla kislina se izloči z urinom (sl. 9-19, B). Kot del hippurata se dušik sprošča iz telesa. Pomanjkanje glicina nadomestimo bodisi s sintezo iz serina bodisi zaradi tvorbe NH3 in CO 2 v reakciji, katalizirani z glicin sintetazo. V tem primeru tvorbo glicina spremlja vezava ene molekule amoniaka.
S hiperammonemijo tipa II (okvara ornitinkarbamoiltransferaze) uvedba velikega
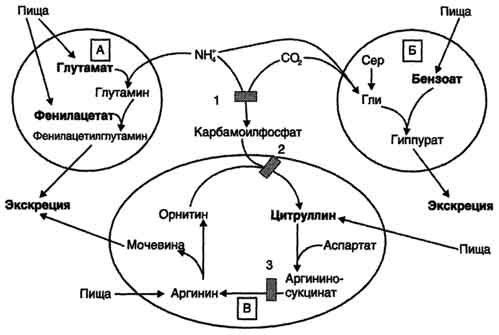
Sl. 9-19. Načini za odstranjevanje amonijaka, ko so v prehrano vključeni glutamat in fenilacetat (A), benzoat (B), citrulin in arginin (C). Na sliki so prikazani encimski bloki: 1 - okvara karbamoilfosfat sintetaza I; 2-okvarjena ornitkarkarmoamtransferaza; 3 - okvara argininosukcinatnega liasa.
odmerki citrulina spodbujajo sintezo sečnine iz aspartata (slika 9-19, B), kar vodi tudi do absorpcije dušika iz telesa. Uvedba velikih odmerkov arginina v argininosukcinaturiji (pomanjkljivost argininosukcinatne liasa) spodbuja regeneracijo ornitina in dušikovega izločanja v citrulinu in argininosukcinatu.
D. Izmenjava amoniaka in aminokislin med organi in tkivi
Številna tkiva sodelujejo pri katabolizmu aminokislin in nastajanju amoniaka. Amoniak se veže v celicah. Dušik se iz telesa izloči v obliki dveh končnih produktov presnove dušika - amonijevih soli (~ 0,5 g / dan), ki nastanejo v ledvicah, in sečnine (~ 25 g / dan), ki vsebuje do 90% izločenega dušika. Urea se v ornitinskem ciklu sintetizira v jetrih, za nastanek 1 mola sečnine se uporablja 1 mol amoniaka in 1 mol asparaginske kisline. Tako porabimo 6,3 g amoniaka in 50 g aspartata za sintezo 25 g sečnine na dan. Za dovajanje dušika v jetra morajo intenzivno delovati posebni mehanizmi.
Transport dušika iz tkiv v jetrase pojavlja predvsem v sestavi 3 spojin: glutamina, alanina, amoniaka (majhna količina v nevezani obliki).
Poleg glutamina in alanina so v krvi prisotne tudi druge proste aminokisline, njihova vsebnost in smer prenosa pa sta odvisni od vnosa hrane in uporabe endogenih beljakovin. Največ prostih aminokislin prihaja iz mišic in črevesja, do 50% pa sta alanin in glutamin. Obstaja usmerjen pretok aminokislin iz teh tkiv v jetra, ki se med absorpcijsko prehrano z beljakovinsko prehrano poveča.
Večina glutamina se dostavi v kri. mišice in možgani.Iz krvnega obtoka ga absorbirajo jetra in ledvice, kjer je izpostavljen glutaminazi. Ledvice- glavni vir serina in delno alanina, ki ga jetra sorbira iz plazme. Možganiza razliko od vseh drugih tkiv lahko absorbira in oksidira velike količine aminokislin z razvejano verigo (valin, levcin, izolevcin).
Po jedi odčrevesje v krvni plazmi prejema veliko aminokislin in
prevladujejo razvejene aminokisline stranske verige (do 20% vseh), ki jih nato absorbirajo predvsem jetra, mišice in možgani (sl. 9-20). V mišicah pride do okrepljenega katabolizma teh aminokislin, ki delujejo kot glavni darovalci aminokiseline pri sintezi alanina iz piruvata (glejte zgoraj "glukozno-alaninski cikel").
V obdobju poabsorpcijeglavni viri prostih aminokislin so mišice. Oskrbujejo predvsem alanin in glutamin (slika 9-21). Alanin absorbirajo jetra, glutamin - črevesje in ledvice. V črevesju se glutaminski dušik prenese v alanin ali serijo in se v njihovi sestavi prenese v jetra, kjer se aktivira proces glukoneogeneze. Intenzivnost glukoneogeneze teh aminokislin je veliko večja kot od vseh drugih. Tako sta alanin in serija glavni glikogeni aminokislini. Aminokisline z razvejano verigo (valin, levcin, izolevcin itd.), Ki se sprostijo iz mišic, pošljejo v možgane, kjer se oksidirajo in služijo kot pomemben vir energije.
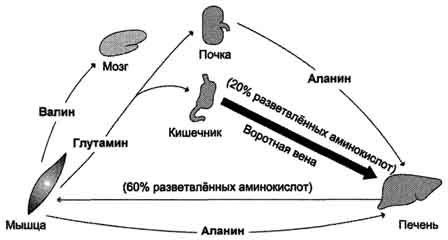
Sl. 9–20. Izmenjava aminokislin med tkivi in \u200b\u200borgani v absorpcijskem obdobju. V absorpcijskem obdobju je črevesje glavni vir prostih aminokislin. Večina vhodnih aminokislin je razvejanih hidrofobnih aminokislin. Eksogene polarne aminokisline iz portalne vene sorbirajo in uporabljajo predvsem jetra. Razvejene aminokisline absorbirajo iz krvnega obtoka možganske ali mišične celice.
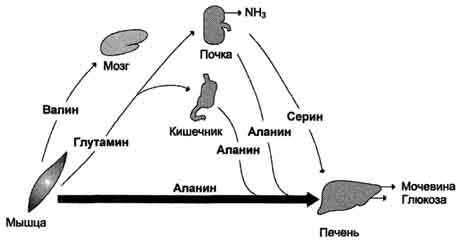
Sl. 9–21. Izmenjava aminokislin med tkivi in \u200b\u200borgani v obdobju postabsorpcije. V obdobju postabsorpcije proste aminokisline prihajajo večinoma iz mišic, v katerih se poveča katabolizem beljakovin. Aminokisline se uporabljajo pri glukoneogenezi v jetrih. V krvi so alanin, serin in glutamin v krvi povišani.
